Επιστημονικός Χειροπράκτης Δρ. Alexander Jimenez ρίχνει μια ματιά οξειδωτικό στρες, τι είναι, πώς επηρεάζει τον οργανισμό και την αντιοξειδωτική άμυνα για να διορθώσει την κατάσταση.
Esra Birben PhD, 1 Umit Murat Sahiner MD, 1 Cansin Sackesen MD, 1 Serpil Erzurum MD, 2 και Omer Kalayci, MD1
Περίληψη: Τα αντιδραστικά είδη οξυγόνου (ROS) παράγονται από ζωντανούς οργανισμούς ως αποτέλεσμα φυσιολογικού κυτταρικού μεταβολισμού και περιβαλλοντικών παραγόντων, όπως οι ατμοσφαιρικοί ρύποι ή ο καπνός του τσιγάρου. Τα ROS είναι μόρια υψηλής αντίδρασης και μπορούν να βλάψουν τις κυτταρικές δομές όπως οι υδατάνθρακες, τα νουκλεϊκά οξέα, τα λιπίδια και οι πρωτεΐνες και να αλλάξουν τις λειτουργίες τους. Η αλλαγή στην ισορροπία μεταξύ οξειδωτικών και αντιοξειδωτικών προς όφελος των οξειδωτικών ονομάζεται «οξειδωτικό στρες». Η ρύθμιση της αναγωγικής και οξειδωτικής (οξειδοαναγωγής) κατάστασης είναι κρίσιμη για τη βιωσιμότητα των κυττάρων, την ενεργοποίηση, τον πολλαπλασιασμό και τη λειτουργία των οργάνων. Οι αερόβιοι οργανισμοί έχουν ενσωματωμένα αντιοξειδωτικά συστήματα, τα οποία περιλαμβάνουν ενζυματικά και μη ενζυματικά αντιοξειδωτικά που είναι συνήθως αποτελεσματικά στον αποκλεισμό των επιβλαβών επιδράσεων των ROS. Ωστόσο, σε παθολογικές καταστάσεις, τα αντιοξειδωτικά συστήματα μπορεί να κατακλυστούν. Το οξειδωτικό στρες συμβάλλει σε πολλές παθολογικές καταστάσεις και ασθένειες, όπως καρκίνο, νευρολογικές διαταραχές, αθηροσκλήρωση, υπέρταση, ισχαιμία/αιμάτωση, διαβήτη, σύνδρομο οξείας αναπνευστικής δυσχέρειας, ιδιοπαθή πνευμονική ίνωση, χρόνια αποφρακτική πνευμονοπάθεια και άσθμα. Σε αυτήν την ανασκόπηση, συνοψίζουμε τα κυτταρικά οξειδωτικά και αντιοξειδωτικά συστήματα και συζητάμε τις κυτταρικές επιδράσεις και τους μηχανισμούς του οξειδωτικού στρες.
Λέξεις κλειδιά: αντιοξειδωτικό, οξειδωτικό, οξειδωτικό στρες, αντιδραστικά είδη οξυγόνου, οξειδοαναγωγή
(WAO Journal 2012; 5:9–19)
Τα αντιδραστικά είδη οξυγόνου (ROS) παράγονται από ζωντανούς οργανισμούς ως αποτέλεσμα του φυσιολογικού κυτταρικού μεταβολισμού. Σε χαμηλές έως μέτριες συγκεντρώσεις, λειτουργούν σε φυσιολογικές κυτταρικές διεργασίες, αλλά σε υψηλές συγκεντρώσεις, προκαλούν δυσμενείς τροποποιήσεις σε κυτταρικά συστατικά, όπως λιπίδια, πρωτεΐνες και DNA.1–6 Η αλλαγή της ισορροπίας μεταξύ οξειδωτικού/αντιοξειδωτικού προς όφελος των οξειδωτικών ονομάζεται «οξειδωτικό στρες». Το οξειδωτικό στρες συμβάλλει σε πολλές παθολογικές καταστάσεις, όπως ο καρκίνος, οι νευρολογικές διαταραχές, η αθηροσκλήρωση 7–10, η υπέρταση, η ισχαιμία/αιμάτωση, ο διαβήτης 11–14, το σύνδρομο οξείας αναπνευστικής δυσχέρειας, η ιδιοπαθής πνευμονική ίνωση, η χρόνια αποφρακτική πνευμονοπάθεια,15 και το άσθμα.16– 21 Οι αερόβιοι οργανισμοί έχουν ενσωματωμένα αντιοξειδωτικά συστήματα, τα οποία περιλαμβάνουν ενζυματικά και μη ενζυματικά αντιοξειδωτικά που είναι συνήθως αποτελεσματικά στον αποκλεισμό των επιβλαβών επιδράσεων των ROS. Ωστόσο, σε παθολογικές καταστάσεις, τα αντιοξειδωτικά συστήματα μπορεί να κατακλυστούν. Σε αυτήν την ανασκόπηση, συνοψίζουμε τα κυτταρικά οξειδωτικά και αντιοξειδωτικά συστήματα και τη ρύθμιση της αναγωγικής και οξειδωτικής (οξειδοαναγωγής) κατάστασης σε καταστάσεις υγείας και ασθένειας.
Πίνακας περιεχομένων
ΟΞΕΙΔΩΤΙΚΑ
Ενδογενείς Πηγές ROS
Τα ROS παράγονται από μοριακό οξυγόνο ως αποτέλεσμα του φυσιολογικού κυτταρικού μεταβολισμού. Τα ROS μπορούν να χωριστούν σε 2 ομάδες: ελεύθερες ρίζες και μη ρίζες. Τα μόρια που περιέχουν ένα ή περισσότερα ασύζευκτα ηλεκτρόνια και έτσι δίνουν αντιδραστικότητα στο μόριο ονομάζονται ελεύθερες ρίζες. Όταν 2 ελεύθερες ρίζες μοιράζονται τα ασύζευκτα ηλεκτρόνια τους, δημιουργούνται μη ριζικές μορφές. Τα 3 κύρια ROS που έχουν φυσιολογική σημασία είναι το ανιόν υπεροξειδίου (O22.), η ρίζα υδροξυλίου (OH) και το υπεροξείδιο του υδρογόνου (H2O2). Τα ROS συνοψίζονται στον Πίνακα 1.
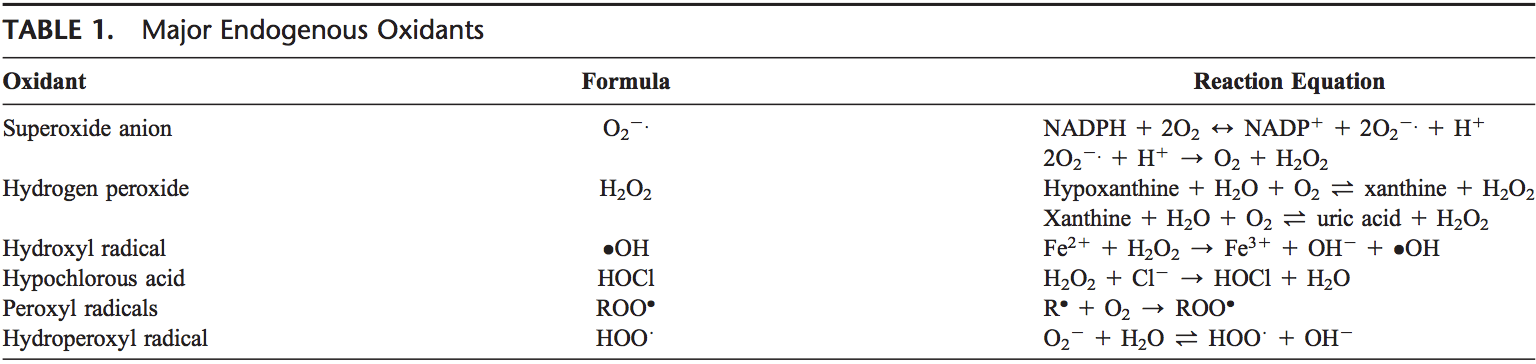 Το ανιόν υπεροξειδίου σχηματίζεται με την προσθήκη 1 ηλεκτρονίου στο μοριακό οξυγόνο.22 Αυτή η διαδικασία μεσολαβείται από τη φωσφορική φωσφορική [NAD(P)H] οξειδάση της νικοτίνης αδενίνης ή την οξειδάση της ξανθίνης ή από το μιτοχονδριακό σύστημα μεταφοράς ηλεκτρονίων. Η κύρια θέση για την παραγωγή ανιόντος υπεροξειδίου είναι τα μιτοχόνδρια, ο μηχανισμός του κυττάρου για την παραγωγή τριφωσφορικής αδενοσίνης. Κανονικά, τα ηλεκτρόνια μεταφέρονται μέσω της μιτοχονδριακής αλυσίδας μεταφοράς ηλεκτρονίων για τη μείωση του οξυγόνου στο νερό, αλλά περίπου το 1 έως 3% όλων των ηλεκτρονίων διαρρέουν από το σύστημα και παράγουν υπεροξείδιο. Η οξειδάση NAD(P)H βρίσκεται σε πολυμορφοπύρηνα λευκοκύτταρα, μονοκύτταρα και μακροφάγα. Κατά τη φαγοκυττάρωση, αυτά τα κύτταρα παράγουν μια έκρηξη υπεροξειδίου που οδηγεί σε βακτηριοκτόνο δράση. Το υπεροξείδιο μετατρέπεται σε υπεροξείδιο του υδρογόνου με τη δράση υπεροξειδίων δισμουτάσης (SODs, EC 1.15.1.1). Το υπεροξείδιο του υδρογόνου διαχέεται εύκολα στην πλασματική μεμβράνη. Το υπεροξείδιο του υδρογόνου παράγεται επίσης από την οξειδάση της ξανθίνης, την οξειδάση αμινοξέων και την οξειδάση NAD(P)H 23,24 και στα υπεροξισώματα από την κατανάλωση μοριακού οξυγόνου σε μεταβολικές αντιδράσεις. Σε μια διαδοχή αντιδράσεων που ονομάζονται αντιδράσεις Haber-Weiss και Fenton, το H2O2 μπορεί να διασπαστεί σε OH2 παρουσία μετάλλων μετάδοσης όπως Fe21 ή Cu21.25
Το ανιόν υπεροξειδίου σχηματίζεται με την προσθήκη 1 ηλεκτρονίου στο μοριακό οξυγόνο.22 Αυτή η διαδικασία μεσολαβείται από τη φωσφορική φωσφορική [NAD(P)H] οξειδάση της νικοτίνης αδενίνης ή την οξειδάση της ξανθίνης ή από το μιτοχονδριακό σύστημα μεταφοράς ηλεκτρονίων. Η κύρια θέση για την παραγωγή ανιόντος υπεροξειδίου είναι τα μιτοχόνδρια, ο μηχανισμός του κυττάρου για την παραγωγή τριφωσφορικής αδενοσίνης. Κανονικά, τα ηλεκτρόνια μεταφέρονται μέσω της μιτοχονδριακής αλυσίδας μεταφοράς ηλεκτρονίων για τη μείωση του οξυγόνου στο νερό, αλλά περίπου το 1 έως 3% όλων των ηλεκτρονίων διαρρέουν από το σύστημα και παράγουν υπεροξείδιο. Η οξειδάση NAD(P)H βρίσκεται σε πολυμορφοπύρηνα λευκοκύτταρα, μονοκύτταρα και μακροφάγα. Κατά τη φαγοκυττάρωση, αυτά τα κύτταρα παράγουν μια έκρηξη υπεροξειδίου που οδηγεί σε βακτηριοκτόνο δράση. Το υπεροξείδιο μετατρέπεται σε υπεροξείδιο του υδρογόνου με τη δράση υπεροξειδίων δισμουτάσης (SODs, EC 1.15.1.1). Το υπεροξείδιο του υδρογόνου διαχέεται εύκολα στην πλασματική μεμβράνη. Το υπεροξείδιο του υδρογόνου παράγεται επίσης από την οξειδάση της ξανθίνης, την οξειδάση αμινοξέων και την οξειδάση NAD(P)H 23,24 και στα υπεροξισώματα από την κατανάλωση μοριακού οξυγόνου σε μεταβολικές αντιδράσεις. Σε μια διαδοχή αντιδράσεων που ονομάζονται αντιδράσεις Haber-Weiss και Fenton, το H2O2 μπορεί να διασπαστεί σε OH2 παρουσία μετάλλων μετάδοσης όπως Fe21 ή Cu21.25
Fe31 + .O2 ?Fe2 + O2 Haber Weiss
Fe2 + H2O2 ?Fe3 + OH + .OH Αντίδραση Fenton
Το ίδιο το O 2 μπορεί επίσης να αντιδράσει με το Η2Ο2 και να δημιουργήσει OH. Μπορεί επίσης να ξεκινήσει την υπεροξείδωση των λιπιδίων λαμβάνοντας ένα ηλεκτρόνιο από πολυακόρεστα λιπαρά οξέα.
Τα κοκκιοκυτταρικά ένζυμα επεκτείνουν περαιτέρω την αντιδραστικότητα του H2O2 μέσω της υπεροξειδάσης των ηωσινοφίλων και της μυελοϋπεροξειδάσης (MPO). Στα ενεργοποιημένα ουδετερόφιλα, το H2O2 καταναλώνεται από το MPO. Παρουσία ιόντων χλωρίου, το H2O2 μετατρέπεται σε υποχλωριώδες οξύ (HOCl). Το HOCl είναι εξαιρετικά οξειδωτικό και παίζει σημαντικό ρόλο στη θανάτωση των παθογόνων στους αεραγωγούς.28 Ωστόσο, το HOCl μπορεί επίσης να αντιδράσει με το DNA και να προκαλέσει αλληλεπιδράσεις DNA-πρωτεΐνης και να παράγει προϊόντα οξείδωσης πυριμιδίνης και να προσθέσει χλωρίδιο στις βάσεις του DNA.29,30 Ηωσινόφιλη υπεροξειδάση και το MPO συμβάλλουν επίσης στο οξειδωτικό στρες με την τροποποίηση των πρωτεϊνών με αλογονώσεις, νίτρωση και διασυνδέσεις πρωτεϊνών μέσω ριζών τυροσυλίου.31–33
Άλλες ελεύθερες ρίζες που προέρχονται από οξυγόνο είναι οι ρίζες υπεροξυλίου (ROO$). Η απλούστερη μορφή αυτών των ριζών είναι η ρίζα υδρο-υπεροξυλίου (HOO$) και παίζει ρόλο στην υπεροξείδωση των λιπαρών οξέων. Οι ελεύθερες ρίζες μπορούν να πυροδοτήσουν αλυσιδωτές αντιδράσεις υπεροξείδωσης λιπιδίων αφαιρώντας ένα άτομο υδρογόνου από έναν άνθρακα μεθυλενίου πλευρικής αλυσίδας. Στη συνέχεια, η λιπιδική ρίζα αντιδρά με το οξυγόνο για να παράγει ρίζα υπεροξυλίου. Η ρίζα υπεροξυλίου ξεκινά μια αλυσιδωτή αντίδραση και μετατρέπει τα πολυακόρεστα λιπαρά οξέα σε υδροϋπεροξείδια λιπιδίων. Τα λιπιδικά υδροϋπεροξείδια είναι πολύ ασταθή και διασπώνται εύκολα σε δευτερογενή προϊόντα, όπως οι αλδεΰδες (όπως η 4-υδροξυ-2,3-νενεάλη) και οι μηλονοδιαλδεΰδες (MDAs). Οι ισοπροστάνες είναι μια άλλη ομάδα προϊόντων υπεροξείδωσης λιπιδίων που παράγονται μέσω της υπεροξείδωσης του αραχιδονικού οξέος και έχουν επίσης βρεθεί ότι είναι αυξημένα στο πλάσμα και στα συμπυκνώματα αναπνοής των ασθματικών.34,35 Η υπεροξείδωση των λιπιδίων διαταράσσει την ακεραιότητα των κυτταρικών μεμβρανών και οδηγεί σε αναδιάταξη του δομή μεμβράνης.
Το υπεροξείδιο του υδρογόνου, η ρίζα υπεροξειδίου, η οξειδωμένη γλουταθειόνη (GSSG), οι MDAs, οι ισοπροστάνες, τα καρβονύλια και η νιτροτυροσίνη μπορούν εύκολα να μετρηθούν από δείγματα πλάσματος, αίματος ή βρογχοκυψελιδικής πλύσης ως βιοδείκτες οξείδωσης με τυποποιημένες αναλύσεις.
Εξωγενής Πηγή Οξειδωτικών
Καπνός τσιγάρου
Ο καπνός του τσιγάρου περιέχει πολλά οξειδωτικά και ελεύθερες ρίζες και οργανικές ενώσεις, όπως το υπεροξείδιο και το μονοξείδιο του αζώτου.36 Επιπλέον, η εισπνοή του καπνού του τσιγάρου στον πνεύμονα ενεργοποιεί επίσης ορισμένους ενδογενείς μηχανισμούς, όπως η συσσώρευση ουδετερόφιλων και μακροφάγων, που αυξάνουν περαιτέρω τον οξειδωτικό τραυματισμό. .
Έκθεση στο Όζον
Η έκθεση στο όζον μπορεί να προκαλέσει υπεροξείδωση των λιπιδίων και να προκαλέσει εισροή ουδετερόφιλων στο επιθήλιο των αεραγωγών. Η βραχυπρόθεσμη έκθεση στο όζον προκαλεί επίσης την απελευθέρωση φλεγμονωδών μεσολαβητών, όπως MPO, κατιονικές πρωτεΐνες ηωσινόφιλων και επίσης γαλακτική αφυδρογονάση και λευκωματίνη.37 Ακόμη και σε υγιή άτομα, η έκθεση στο όζον προκαλεί μείωση των πνευμονικών λειτουργιών.38 Οι Cho et al39 έχουν δείξει ότι Τα σωματίδια (μείγμα στερεών σωματιδίων και υγρών σταγονιδίων που αιωρούνται στον αέρα) καταλύουν τη μείωση του οξυγόνου.
Υπεροξία
Η υπεροξία αναφέρεται σε καταστάσεις υψηλότερων επιπέδων οξυγόνου από την κανονική μερική πίεση οξυγόνου στους πνεύμονες ή σε άλλους ιστούς του σώματος. Οδηγεί σε μεγαλύτερη παραγωγή ενεργών ειδών οξυγόνου και αζώτου.40,41
Ιοντίζουσα ακτινοβολία
Η ιονίζουσα ακτινοβολία, παρουσία Ο2, μετατρέπει τις ρίζες υδροξυλίου, υπεροξειδίου και οργανικές ρίζες σε υπεροξείδιο του υδρογόνου και οργανικά υδροϋπεροξείδια. Αυτά τα είδη υδροϋπεροξειδίου αντιδρούν με οξειδοαναγωγικά ενεργά μεταλλικά ιόντα, όπως Fe και Cu, μέσω αντιδράσεων Fenton και έτσι προκαλούν οξειδωτικό στρες.42,43 Narayanan et al44 έδειξαν ότι οι ινοβλάστες που εκτέθηκαν σε σωματίδια άλφα είχαν σημαντικές αυξήσεις στο ενδοκυτταρικό O2 2. και H2O2 παραγωγή μέσω της δεσμευμένης στη μεμβράνη του πλάσματος οξειδάσης NADPH.44 Μόρια μεταγωγής σήματος, όπως εξωκυτταρική κινάση 1 και 2 που ρυθμίζεται από το σήμα (ERK1/2), C-Jun N-τερματική κινάση (JNK) και p38, και παράγοντες μεταγραφής, όπως ενεργοποιείται πρωτεΐνη-1 (AP-1), πυρηνικός παράγοντας-kB (NF-kB) και p53, τα οποία έχουν ως αποτέλεσμα την έκφραση γονιδίων που σχετίζονται με την απόκριση ακτινοβολίας. 45-50 υπεριώδη φωτόνια Α (UVA) πυροδοτούν οξειδωτικές αντιδράσεις με διέγερση ενδογενών φωτοευαισθητοποιητών, όπως πορφυρίνες, οξειδάση NADPH και ριβοφλαβίνες. Η 8-Oxo-7,8-διυδρογουανίνη (8-oxoGua) είναι το κύριο προϊόν οξείδωσης DNA με τη μεσολάβηση UVA που σχηματίζεται από την οξείδωση της ρίζας ΟΗ, των οξειδωτικών 1-ηλεκτρονίου και του απλού οξυγόνου που αντιδρά κυρίως με τη γουανίνη.51 Ο σχηματισμός γουανίνης Το ριζικό κατιόν στο απομονωμένο DNA έχει αποδειχθεί ότι εμφανίζεται αποτελεσματικά μέσω της άμεσης επίδρασης της ιονίζουσας ακτινοβολίας.52,53 Μετά την έκθεση σε ιονίζουσα ακτινοβολία, το ενδοκυτταρικό επίπεδο της γλουταθειόνης (GSH) μειώνεται για βραχυπρόθεσμο αλλά στη συνέχεια αυξάνεται ξανά.54
Ιόντα βαρέων μετάλλων
Τα ιόντα βαρέων μετάλλων, όπως ο σίδηρος, ο χαλκός, το κάδμιο, ο υδράργυρος, το νικέλιο, ο μόλυβδος και το αρσενικό, μπορούν να προκαλέσουν παραγωγή αντιδραστικών ριζών και να προκαλέσουν κυτταρική βλάβη μέσω της εξάντλησης των ενζυμικών δραστηριοτήτων μέσω της υπεροξείδωσης των λιπιδίων και της αντίδρασης με πυρηνικές πρωτεΐνες και DNA.55
Ένας από τους πιο σημαντικούς μηχανισμούς παραγωγής ελεύθερων ριζών με τη μεσολάβηση μετάλλων είναι μέσω μιας αντίδρασης τύπου Fenton. Το ιόν υπεροξειδίου και το υπεροξείδιο του υδρογόνου μπορούν να αλληλεπιδράσουν με μέταλλα μετάπτωσης, όπως ο σίδηρος και ο χαλκός, μέσω της καταλυόμενης από μέταλλο αντίδρασης Haber–Weiss/Fenton για να σχηματίσουν ρίζες ΟΗ.
Μέταλλο31 1 $O2 /Μέταλλο21 1 O2 Haber Weiss Metal21 1 H2 O2 /Μέταλλο31 1 OH 2 1 $OH Αντίδραση Fenton
Εκτός από τους μηχανισμούς τύπου Fenton και τύπου Haber-Weiss, ορισμένα μεταλλικά ιόντα μπορούν να αντιδράσουν απευθείας με κυτταρικά μόρια για να δημιουργήσουν ελεύθερες ρίζες, όπως ρίζες θειόλης, ή να επάγουν μονοπάτια κυτταρικής σηματοδότησης. Αυτές οι ρίζες μπορεί επίσης να αντιδράσουν με άλλα μόρια θειόλης για να δημιουργήσουν O22.. O22. μετατρέπεται σε H2O2, το οποίο προκαλεί πρόσθετη παραγωγή ριζών οξυγόνου. Ορισμένα μέταλλα, όπως ο αρσενίτης, προκαλούν το σχηματισμό ROS έμμεσα με την ενεργοποίηση συστημάτων παραγωγής ριζών στα κύτταρα.56
Το αρσενικό είναι ένα εξαιρετικά τοξικό στοιχείο που παράγει μια ποικιλία από ROS, συμπεριλαμβανομένου του υπεροξειδίου (O2 2), του απλού οξυγόνου (1O2), της ρίζας υπεροξυλίου (ROO), του μονοξειδίου του αζώτου (NO), του υπεροξειδίου του υδρογόνου (H2O2) και των διμεθυλαρσινικών υπεροξυλικών ριζών [( CH3)2AsOO ].57–59 Οι ενώσεις του αρσενικού (III) μπορούν να αναστείλουν τα αντιοξειδωτικά ένζυμα, ειδικά τα εξαρτώμενα από GSH ένζυμα, όπως οι γλουταθειόνη-S-τρανσφεράσες (GSTs), η υπεροξειδάση της γλουταθειόνης (GSH-Px) και η αναγωγάση GSH, μέσω δέσμευσης - στις σουλφυδρυλικές (–SH) ομάδες τους.60,61
Ο μόλυβδος αυξάνει την υπεροξείδωση των λιπιδίων.62 Σημαντικές μειώσεις στη δραστηριότητα του SOD ιστού και του εγκεφάλου GPx έχουν αναφερθεί μετά από έκθεση σε μόλυβδο.63,64 Η αντικατάσταση του ψευδαργύρου, ο οποίος χρησιμεύει ως συμπαράγοντας για πολλά ένζυμα από τον μόλυβδο, οδηγεί σε αδρανοποίηση τέτοιων ενζύμων. Η έκθεση σε μόλυβδο μπορεί να προκαλέσει αναστολή της GST επηρεάζοντας τις θειόλες των ιστών.
Τα ROS που παράγονται από αντιδράσεις που καταλύονται με μέταλλα μπορούν να τροποποιήσουν τις βάσεις του DNA. Τρεις υποκαταστάσεις βάσεων, G/C, G/T και C/T, μπορούν να συμβούν ως αποτέλεσμα οξειδωτικής βλάβης από μεταλλικά ιόντα, όπως Fe21, Cu21 και Ni21. Οι Reid et al65 έδειξαν ότι το G/C παρήχθη κυρίως από Fe21 ενώ η C/T υποκατάσταση έγινε από Cu21 και Ni21.
ΑΝΤΙΟΞΕΙΔΩΤΙΚΑ
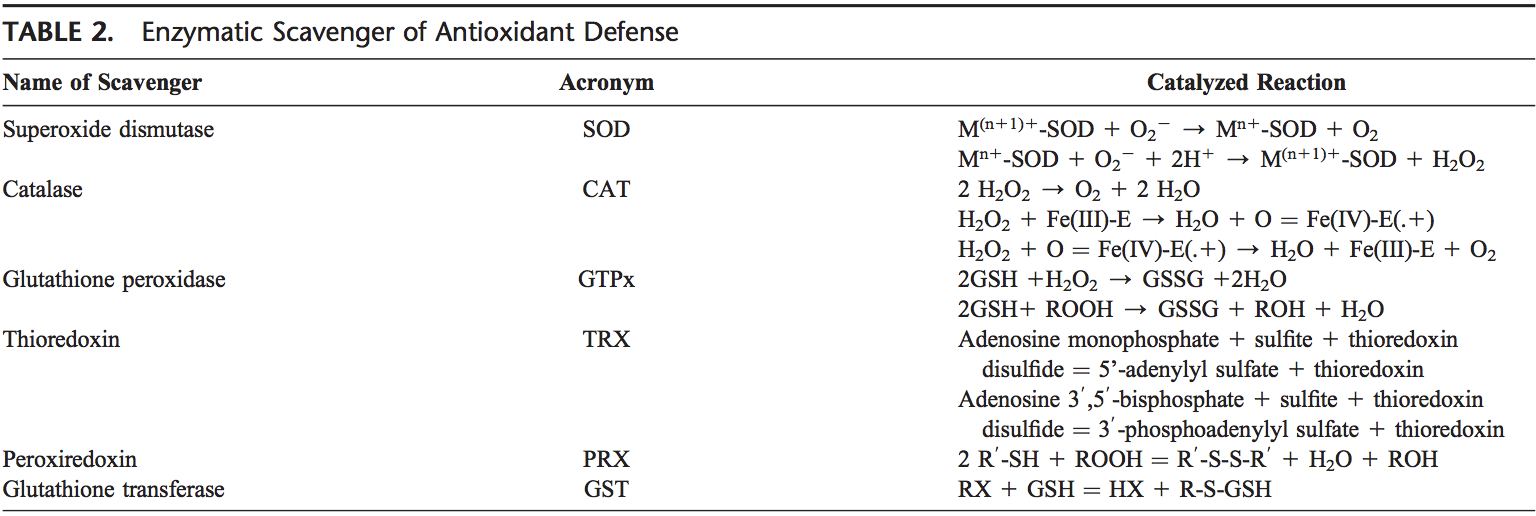
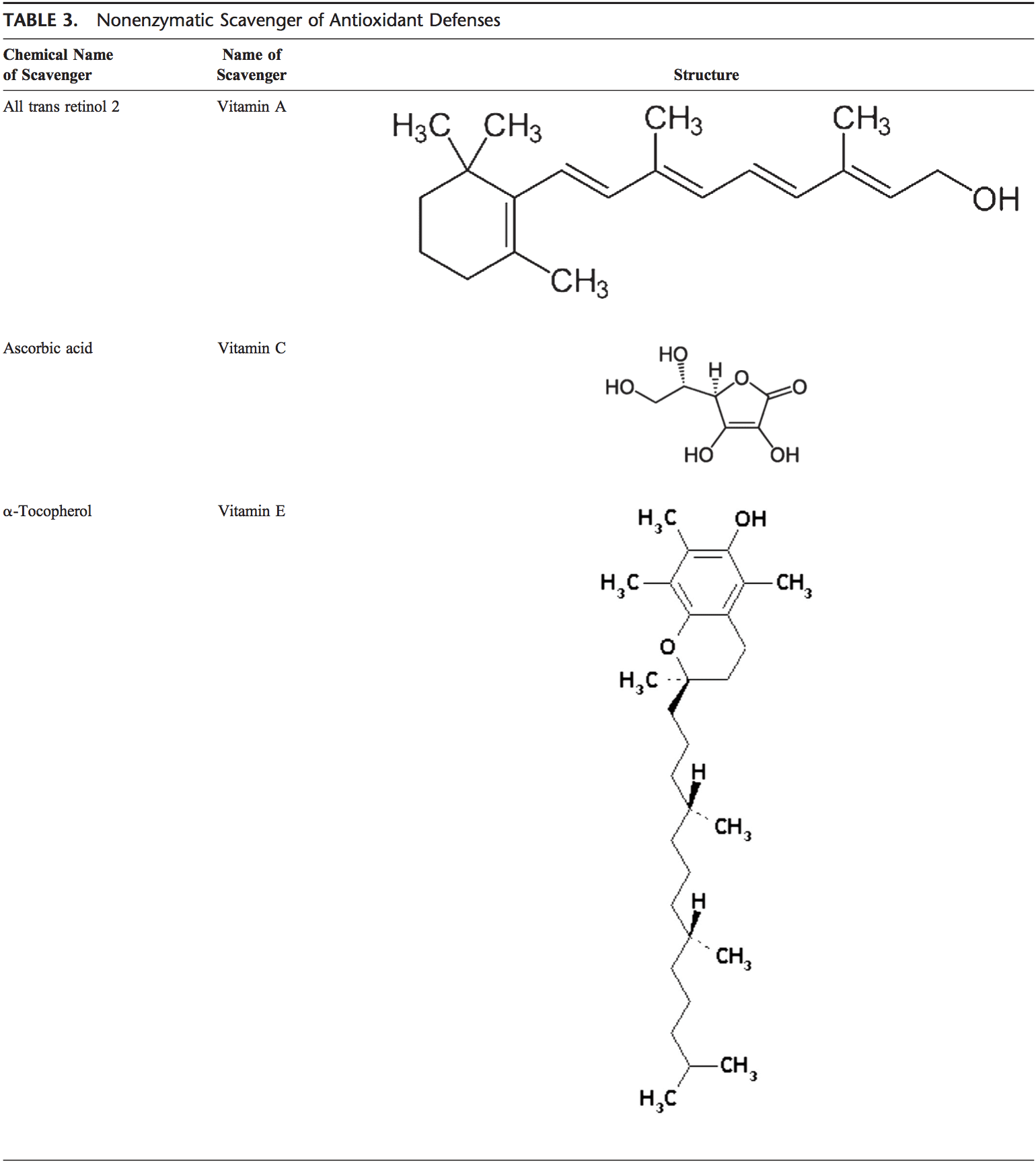
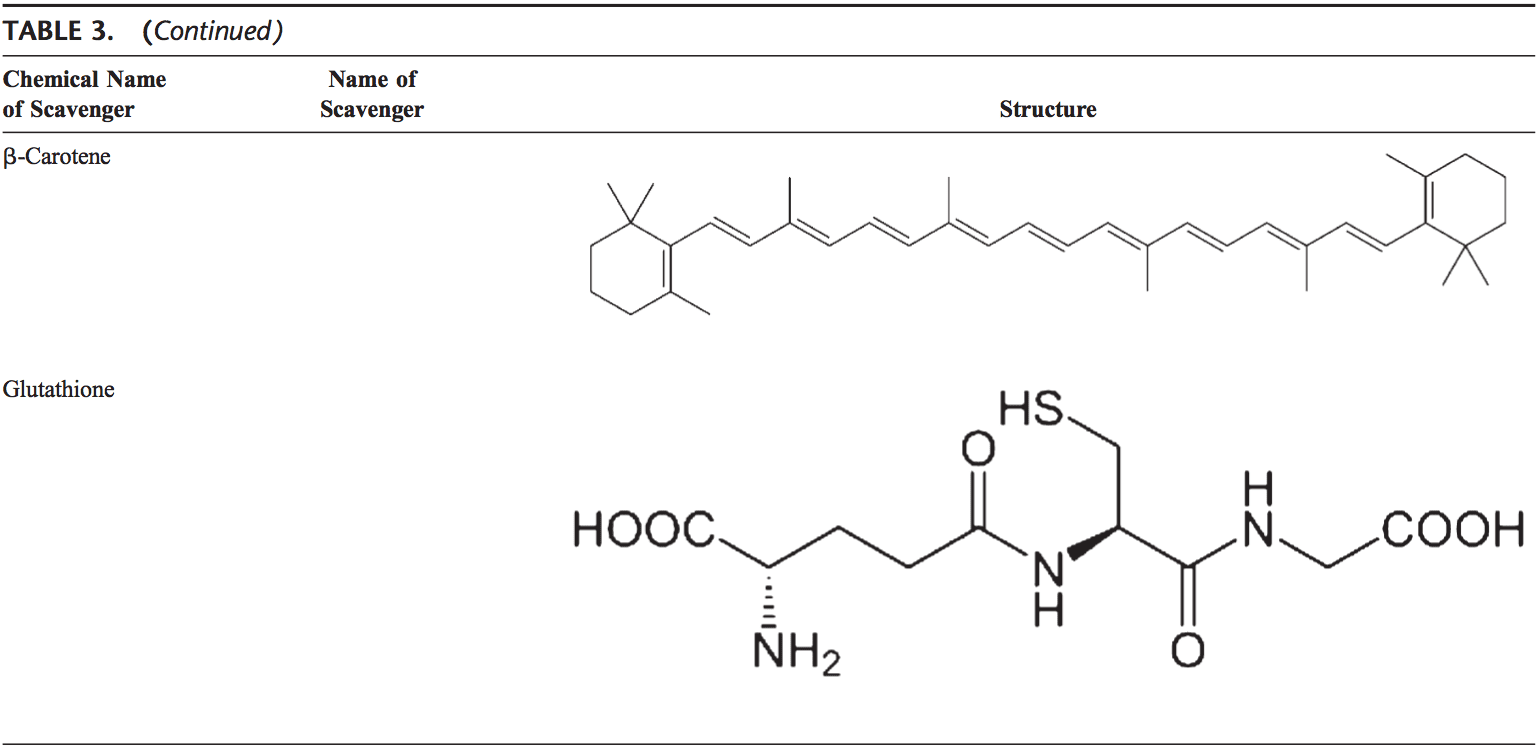
Το ανθρώπινο σώμα είναι εξοπλισμένο με μια ποικιλία αντιοξειδωτικών που χρησιμεύουν για να αντισταθμίσουν την επίδραση των οξειδωτικών. Για όλους τους πρακτικούς σκοπούς, αυτά μπορούν να χωριστούν σε 2 κατηγορίες: ενζυματικά (Πίνακας 2) και μη ενζυματικά (Πίνακας 3).
Ενζυματικά Αντιοξειδωτικά
Τα κύρια ενζυματικά αντιοξειδωτικά των πνευμόνων είναι τα SOD (EC 1.15.1.11), η καταλάση (EC 1.11.1.6) και η GSH-Px (EC 1.11.1.9). Εκτός από αυτά τα κύρια ένζυμα, άλλα αντιοξειδωτικά, συμπεριλαμβανομένης της αίμης οξυγενάσης-1 (EC 1.14.99.3) και οξειδοαναγωγικές πρωτεΐνες, όπως οι θειορεδοξίνες (TRXs, EC 1.8.4.10), οι υπεροξιρεδοξίνες (PRXs, EC 1.11.1.15) και οι γλουταροδοξίνες , έχει επίσης βρεθεί ότι παίζουν κρίσιμους ρόλους στην πνευμονική αντιοξειδωτική άμυνα.
Δεδομένου ότι το υπεροξείδιο είναι το πρωτεύον ROS που παράγεται από διάφορες πηγές, η διάσπασή του από το SOD είναι πρωταρχικής σημασίας για κάθε κύτταρο. Και οι 3 μορφές SOD, δηλαδή CuZn-SOD, Mn-SOD και EC-SOD, εκφράζονται ευρέως στον ανθρώπινο πνεύμονα. Το Mn-SOD εντοπίζεται στη μήτρα των μιτοχονδρίων. Το EC-SOD εντοπίζεται κυρίως στην εξωκυτταρική μήτρα, ειδικά σε περιοχές που περιέχουν υψηλές ποσότητες ινών κολλαγόνου τύπου Ι και γύρω από πνευμονικά και συστηματικά αγγεία. Έχει επίσης ανιχνευθεί στο βρογχικό επιθήλιο, στο κυψελιδικό επιθήλιο και στα κυψελιδικά μακροφάγα.66,67 Συνολικά, το CuZn-SOD και το Mn-SOD γενικά πιστεύεται ότι δρουν ως σαρωτές όγκου ριζών υπεροξειδίου. Το σχετικά υψηλό επίπεδο EC-SOD στον πνεύμονα με την ειδική δέσμευσή του στα συστατικά της εξωκυτταρικής μήτρας μπορεί να αντιπροσωπεύει ένα θεμελιώδες συστατικό της προστασίας της μήτρας του πνεύμονα.68
Το H2O2 που παράγεται από τη δράση των SOD ή τη δράση οξειδασών, όπως η οξειδάση της ξανθίνης, ανάγεται σε νερό από την καταλάση και το GSH-Px. Η καταλάση υπάρχει ως τετραμερές που αποτελείται από 4 πανομοιότυπα μονομερή, καθένα από τα οποία περιέχει μια ομάδα αίμης στην ενεργό θέση. Η αποικοδόμηση του H2O2 επιτυγχάνεται μέσω της μετατροπής μεταξύ 2 διαμορφώσεων της καταλάσης-σιδηροκαταλάσης (σίδηρος που συντονίζεται με νερό) και της ένωσης I (σίδηρος συμπλεγμένος με ένα άτομο οξυγόνου). Η καταλάση δεσμεύει επίσης το NADPH ως αναγωγικό ισοδύναμο για την πρόληψη της οξειδωτικής αδρανοποίησης του ενζύμου (σχηματισμός της ένωσης II) από το H2O2 καθώς ανάγεται σε νερό.69
Τα ένζυμα στον κύκλο οξειδοαναγωγής που είναι υπεύθυνα για τη μείωση του H2O2 και των λιπιδικών υδροϋπεροξειδίων (που δημιουργούνται ως αποτέλεσμα της υπεροξείδωσης των λιπιδίων της μεμβράνης) περιλαμβάνουν τα GSH-Pxs.70 Τα GSH-Pxs είναι μια οικογένεια τετραμερών ενζύμων που περιέχουν το μοναδικό αμινοξύ σεληνοκυστεΐνη. ενεργών θέσεων και χρησιμοποιούν θειόλες χαμηλού μοριακού βάρους, όπως η GSH, για τη μείωση του H2O2 και των υπεροξειδίων των λιπιδίων στις αντίστοιχες αλκοόλες τους. Έχουν περιγραφεί τέσσερα GSH-Px, τα οποία κωδικοποιούνται από διαφορετικά γονίδια: Το GSH-Px-1 (κυτταρικό GSH-Px) είναι πανταχού παρόν και μειώνει το H2O2 και τα υπεροξείδια λιπαρών οξέων, αλλά όχι τα εστεροποιημένα υπεροξυλικά λιπίδια.71 Τα εστεροποιημένα λιπίδια μειώνονται από τη συνδεδεμένη με τη μεμβράνη GSH -Px-4 (φωσφολιπιδικό υδροϋπεροξείδιο GSH-Px), το οποίο μπορεί να χρησιμοποιήσει αρκετές διαφορετικές θειόλες χαμηλού μοριακού βάρους ως αναγωγικά ισοδύναμα. Το GSH-Px-2 (γαστρεντερικό GSH-Px) εντοπίζεται στα γαστρεντερικά επιθηλιακά κύτταρα όπου χρησιμεύει για τη μείωση των διατροφικών υπεροξειδίων.72 Το GSH-Px-3 (εξωκυτταρικό GSH-Px) είναι το μόνο μέλος της οικογένειας GSH-Px που κατοικεί σε το εξωκυτταρικό διαμέρισμα και πιστεύεται ότι είναι ένα από τα πιο σημαντικά εξωκυτταρικά αντιοξειδωτικά ένζυμα στα θηλαστικά. Από αυτές, η εξωκυτταρική GSH-Px διερευνάται ευρύτερα στον ανθρώπινο πνεύμονα.73
Επιπλέον, η απόρριψη του H2O2 συνδέεται στενά με πολλά ένζυμα που περιέχουν θειόλη, συγκεκριμένα, TRXs (TRX1 και TRX2), αναγωγάσες θειορεδοξίνης (EC 1.8.1.9) (TRRs), PRXs (που είναι υπεροξειδάσες θειορεδοξίνης) και γλουταροξίνες.
Δύο TRX και TRRs έχουν χαρακτηριστεί σε ανθρώπινα κύτταρα, που υπάρχουν τόσο στο κυτοσόλιο όσο και στα μιτοχόνδρια. Στον πνεύμονα, το TRX και το TRR εκφράζονται σε βρογχικό και κυψελιδικό επιθήλιο και μακροφάγα. Έξι διαφορετικά PRXs έχουν βρεθεί σε ανθρώπινα κύτταρα, που διαφέρουν ως προς την υπερδομική διαμερισματοποίησή τους. Πειραματικές μελέτες έχουν αποκαλύψει τη σημασία του PRX VI στην προστασία του κυψελιδικού επιθηλίου. Ο ανθρώπινος πνεύμονας εκφράζει όλα τα PRX στο βρογχικό επιθήλιο, το κυψελιδικό επιθήλιο και τα μακροφάγα.75 Το PRX V βρέθηκε πρόσφατα ότι λειτουργεί ως αναγωγάση υπεροξυνιτρώδους,76, πράγμα που σημαίνει ότι μπορεί να λειτουργήσει ως πιθανή προστατευτική ένωση στην ανάπτυξη πνευμονικής βλάβης που προκαλείται από ROS .77
Κοινό σε αυτά τα αντιοξειδωτικά είναι η απαίτηση για NADPH ως αναγωγικό ισοδύναμο. Το NADPH διατηρεί την καταλάση στη δραστική μορφή και χρησιμοποιείται ως συμπαράγοντας από την TRX και την αναγωγάση GSH (EC 1.6.4.2), η οποία μετατρέπει το GSSG σε GSH, ένα συν-υπόστρωμα για τα GSH-Pxs. Το ενδοκυτταρικό NADPH, με τη σειρά του, δημιουργείται από την αναγωγή του NADP1 από την αφυδρογονάση της γλυκόζης-6-φωσφορικής, το πρώτο και περιοριστικό της ταχύτητας ένζυμο της οδού της φωσφορικής πεντόζης, κατά τη μετατροπή της 6-φωσφορικής γλυκόζης σε 6-φωσφογλυκονολακτόνη. Με τη δημιουργία NADPH, η αφυδρογονάση της γλυκόζης-6-φωσφορικής είναι ένας κρίσιμος καθοριστικός παράγοντας της ρυθμιστικής ικανότητας του κυτοσολικού GSH (GSH/GSSG) και, ως εκ τούτου, μπορεί να θεωρηθεί απαραίτητο, ρυθμιστικό αντιοξειδωτικό ένζυμο.78,79
Τα GST (EC 2.5.1.18), μια άλλη οικογένεια αντιοξειδωτικών ενζύμων, αδρανοποιούν δευτερογενείς μεταβολίτες, όπως ακόρεστες αλδεΰδες, εποξείδια και υδροϋπεροξείδια. Τρεις κύριες οικογένειες GST έχουν περιγραφεί: κυτταροσολική GST, μιτοχονδριακή GST, 80,81 και σχετιζόμενη με τη μεμβράνη μικροσωμική GST που παίζει ρόλο στον μεταβολισμό των εικοσανοειδών και της GSH. Pi, Sigma, Theta, Omega και Zeta.82–83 Κατά τη διάρκεια μη καταπονημένων συνθηκών, οι GST της τάξης Mu και Pi αλληλεπιδρούν με τις κινάσες Ask86 και JNK, αντίστοιχα, και αναστέλλουν αυτές τις κινάσες.1–87 Έχει αποδειχθεί ότι το GSTP89 διαχωρίζεται από JNK ως απόκριση στο οξειδωτικό στρες.1 Το GSTP89 αλληλεπιδρά επίσης φυσικά με το PRX VI και οδηγεί στην ανάκτηση της δραστηριότητας του ενζύμου PRX μέσω γλουταθειονυλίωσης της οξειδωμένης πρωτεΐνης.1
Μη ενζυματικά αντιοξειδωτικά
Τα μη ενζυματικά αντιοξειδωτικά περιλαμβάνουν ενώσεις χαμηλού μοριακού βάρους, όπως βιταμίνες (βιταμίνες C και E), β-καροτίνη, ουρικό οξύ και GSH, ένα τριπεπτίδιο (Lg-γλουταμυλ-L-κυστεϊνυλ-L-γλυκίνη) που περιλαμβάνει μια θειόλη ( σουλφυδρυλ) ομάδα.
Η βιταμίνη C (ασκορβικό οξύ)
Η υδατοδιαλυτή βιταμίνη C (ασκορβικό οξύ) παρέχει αντιοξειδωτική ικανότητα ενδοκυττάριας και εξωκυτταρικής υδατικής φάσης κυρίως με τον καθαρισμό των ελεύθερων ριζών οξυγόνου. Μετατρέπει τις ελεύθερες ρίζες της βιταμίνης Ε σε βιταμίνη Ε. Τα επίπεδά της στο πλάσμα έχουν αποδειχθεί ότι μειώνονται με την ηλικία.91,92
Βιταμίνη Ε (α-τοκοφερόλη)
Η λιποδιαλυτή βιταμίνη Ε συγκεντρώνεται στην υδρόφοβη εσωτερική θέση της κυτταρικής μεμβράνης και είναι η κύρια άμυνα έναντι τραυματισμού της μεμβράνης που προκαλείται από οξειδωτικά. Η βιταμίνη Ε δίνει ηλεκτρόνια στη ρίζα υπεροξυλίου, η οποία παράγεται κατά την υπεροξείδωση των λιπιδίων. Η α-τοκοφερόλη είναι η πιο ενεργή μορφή βιταμίνης Ε και το κύριο αντιοξειδωτικό που συνδέεται με τη μεμβράνη στα κύτταρα. Η βιταμίνη Ε πυροδοτεί την απόπτωση των καρκινικών κυττάρων και αναστέλλει τους σχηματισμούς ελεύθερων ριζών.93
Η γλουταθειόνη
Η GSH είναι σε μεγάλη αφθονία σε όλα τα κυτταρικά διαμερίσματα και είναι το κύριο διαλυτό αντιοξειδωτικό. Ο λόγος GSH/GSSG είναι ένας κύριος καθοριστικός παράγοντας του οξειδωτικού στρες. Η GSH δείχνει τα αντιοξειδωτικά της αποτελέσματα με διάφορους τρόπους.94 Αποτοξινώνει το υπεροξείδιο του υδρογόνου και τα υπεροξείδια των λιπιδίων μέσω της δράσης του GSH-Px. Η GSH δωρίζει το ηλεκτρόνιό της στο H2O2 για να το αναγάγει σε H2O και O2. Το GSSG ανάγεται και πάλι σε GSH από την αναγωγάση GSH που χρησιμοποιεί το NAD(P)H ως δότη ηλεκτρονίων. Τα GSH-Px είναι επίσης σημαντικά για την προστασία της κυτταρικής μεμβράνης από την υπεροξείδωση των λιπιδίων. Η μειωμένη γλουταθειόνη δίνει πρωτόνια στα λιπίδια της μεμβράνης και τα προστατεύει από οξειδωτικές επιθέσεις.95
Η GSH είναι συμπαράγοντας για πολλά αποτοξινωτικά ένζυμα, όπως το GSH-Px και η τρανσφεράση. Παίζει ρόλο στη μετατροπή της βιταμίνης C και Ε στις ενεργές τους μορφές. Η GSH προστατεύει τα κύτταρα από την απόπτωση αλληλεπιδρώντας με προαποπτωτικές και αντιαποπτωτικές οδούς σηματοδότησης.94 Επίσης, ρυθμίζει και ενεργοποιεί αρκετούς μεταγραφικούς παράγοντες, όπως AP-1, NF-kB και Sp-1.
Καροτενοειδή (β-καροτίνη)
Τα καροτενοειδή είναι χρωστικές ουσίες που βρίσκονται στα φυτά. Κυρίως, η β-καροτίνη έχει βρεθεί ότι αντιδρά με ρίζες υπεροξυλίου (ROO), υδροξυλίου (ΟΗ) και υπεροξειδίου (O22.). 96 Τόσο τα καροτενοειδή όσο και τα ρετινοϊκά οξέα (RAs) είναι ικανά να ρυθμίζουν τους μεταγραφικούς παράγοντες.97 Η β-καροτίνη αναστέλλει την επαγόμενη από οξειδωτικά ενεργοποίηση του NF-kB και την παραγωγή ιντερλευκίνης (IL)-98 και παράγοντα νέκρωσης όγκου-a. Τα καροτενοειδή επηρεάζουν επίσης την απόπτωση των κυττάρων. Οι αντιπολλαπλασιαστικές επιδράσεις της ΡΑ έχουν αποδειχθεί σε αρκετές μελέτες. Αυτή η επίδραση της ΡΑ μεσολαβείται κυρίως από υποδοχείς ρετινοϊκού οξέος και ποικίλλει μεταξύ των τύπων κυττάρων. Σε κύτταρα καρκινώματος του μαστού, ο υποδοχέας ρετινοϊκού οξέος αποδείχθηκε ότι πυροδοτεί αναστολή της ανάπτυξης προκαλώντας διακοπή του κυτταρικού κύκλου, απόπτωση ή και τα δύο.6
Η ΕΠΙΔΡΑΣΗ ΤΟΥ ΟΞΕΙΔΩΤΙΚΟΥ ΣΤΡΕΣ: ΓΕΝΕΤΙΚΟΙ, ΦΥΣΙΟΛΟΓΙΚΟΙ & ΒΙΟΧΗΜΙΚΟΙ ΜΗΧΑΝΙΣΜΟΙ
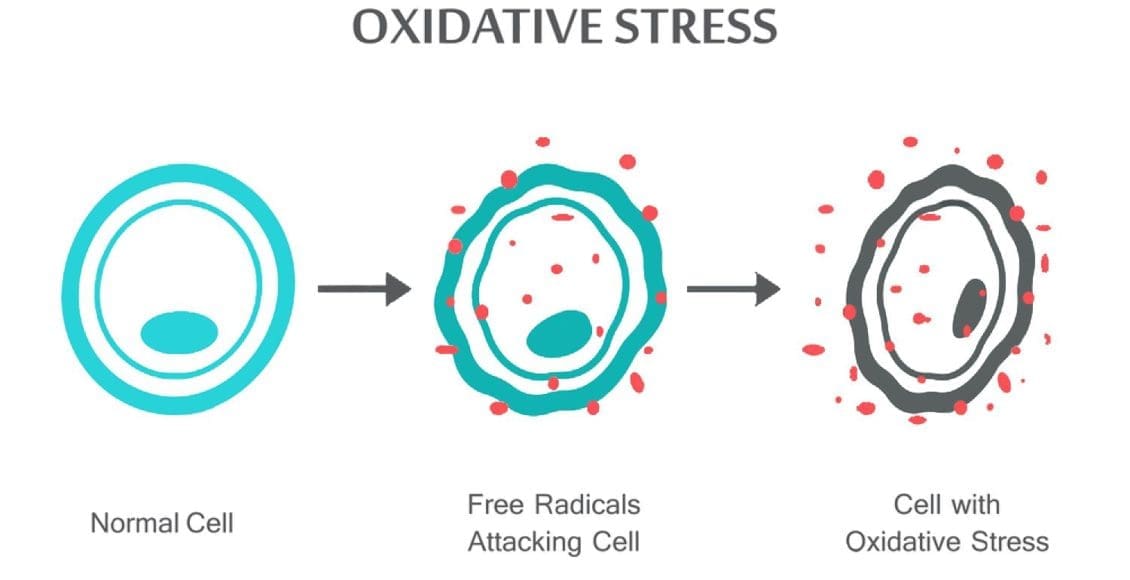
Το οξειδωτικό στρες εμφανίζεται όταν η ισορροπία μεταξύ αντιοξειδωτικών και ROS διαταράσσεται είτε λόγω εξάντλησης των αντιοξειδωτικών είτε λόγω συσσώρευσης ROS. Όταν εμφανίζεται οξειδωτικό στρες, τα κύτταρα προσπαθούν να εξουδετερώσουν τις οξειδωτικές επιδράσεις και να αποκαταστήσουν την ισορροπία οξειδοαναγωγής με ενεργοποίηση ή σίγαση γονιδίων που κωδικοποιούν αμυντικά ένζυμα, παράγοντες μεταγραφής και δομικές πρωτεΐνες.101,102 Η αναλογία μεταξύ οξειδωμένης και ανηγμένης γλουταθειόνης (2GSH/GSSG) είναι μία από τους σημαντικούς καθοριστικούς παράγοντες του οξειδωτικού στρες στον οργανισμό. Η υψηλότερη παραγωγή ROS στο σώμα μπορεί να αλλάξει τη δομή του DNA, να οδηγήσει σε τροποποίηση πρωτεϊνών και λιπιδίων, ενεργοποίηση αρκετών μεταγραφικών παραγόντων που προκαλούνται από το στρες και παραγωγή προφλεγμονωδών και αντιφλεγμονωδών κυτοκινών.
Επιδράσεις του οξειδωτικού στρες στο DNA
Το ROS μπορεί να οδηγήσει σε τροποποιήσεις του DNA με διάφορους τρόπους, που περιλαμβάνει αποικοδόμηση βάσεων, μονόκλωνα ή δίκλωνα σπασίματα DNA, τροποποιήσεις πουρίνης, πυριμιδίνης ή σακχάρου, μεταλλάξεις, διαγραφές ή μετατοπίσεις και διασύνδεση με πρωτεΐνες. Οι περισσότερες από αυτές τις τροποποιήσεις του DNA (Εικ. 1) σχετίζονται σε μεγάλο βαθμό με την καρκινογένεση, τη γήρανση και τις νευροεκφυλιστικές, καρδιαγγειακές και αυτοάνοσες ασθένειες. Ο καπνός του τσιγάρου, τα οξειδοαναγωγικά μέταλλα και τα μη οξειδοαναγωγικά μέταλλα, όπως ο σίδηρος, το κάδμιο, το χρώμιο και το αρσενικό, εμπλέκονται επίσης στην καρκινογένεση και τη γήρανση δημιουργώντας ελεύθερες ρίζες ή δεσμεύοντας με ομάδες θειόλης. Ο σχηματισμός του 8-OH-G είναι η πιο γνωστή βλάβη του DNA που συμβαίνει μέσω οξειδωτικού στρες και είναι ένας πιθανός βιοδείκτης για καρκινογένεση.
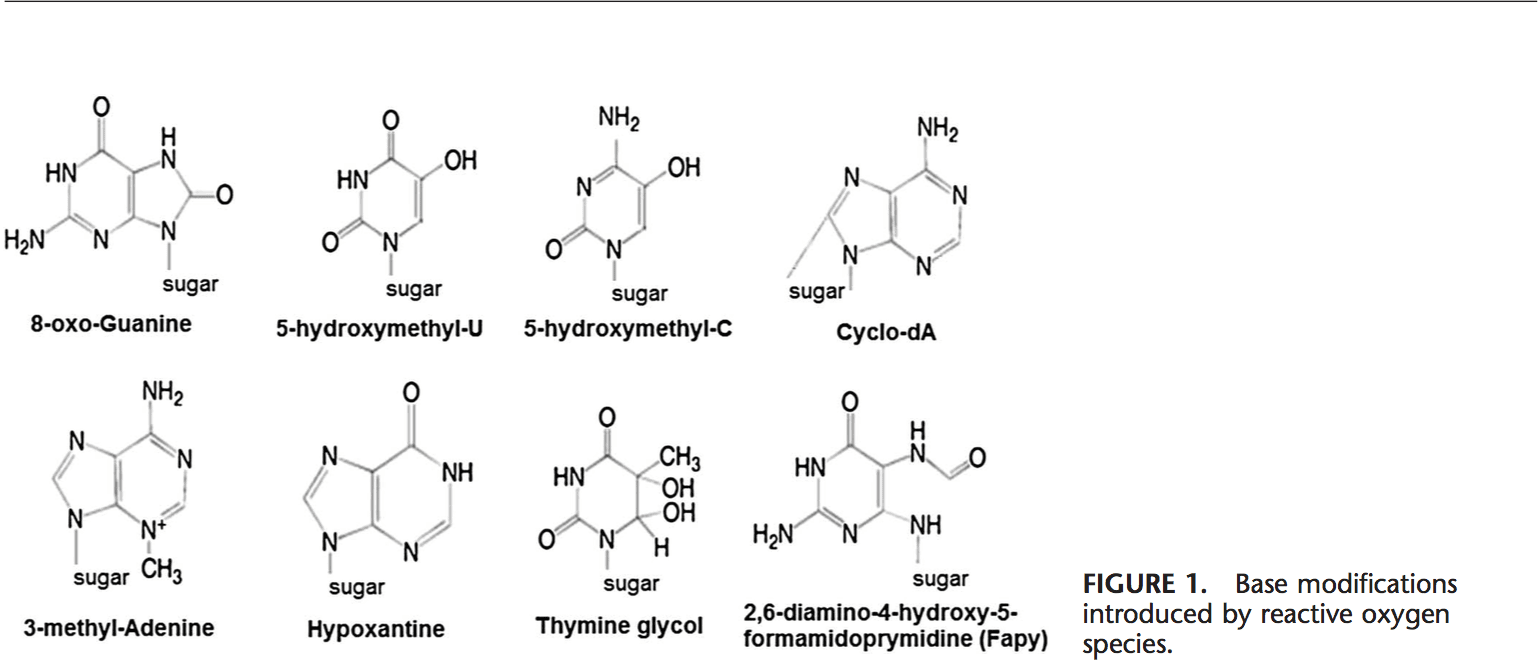
Οι περιοχές προαγωγών των γονιδίων περιέχουν συναινετικές αλληλουχίες για μεταγραφικούς παράγοντες. Αυτές οι θέσεις δέσμευσης μεταγραφικού παράγοντα περιέχουν αλληλουχίες πλούσιες σε GC που είναι επιρρεπείς σε οξειδωτικές επιθέσεις. Ο σχηματισμός DNA 8-OH-G σε θέσεις δέσμευσης μεταγραφικού παράγοντα μπορεί να τροποποιήσει τη δέσμευση των παραγόντων μεταγραφής και έτσι να αλλάξει την έκφραση των σχετικών γονιδίων όπως έχει αποδειχθεί για τις αλληλουχίες-στόχους AP-1 και Sp-1 Εκτός από το 103-OH-G, Η 8-κυκλο-8,59-δεοξυαδενοσίνη (κυκλο-dA) έχει επίσης αποδειχθεί ότι αναστέλλει τη μεταγραφή από ένα γονίδιο αναφοράς σε ένα κυτταρικό σύστημα εάν βρίσκεται σε ένα κουτί TATA.29 Η πρωτεΐνη που δεσμεύει TATA ξεκινά τη μεταγραφή αλλάζοντας την κάμψη του DNA . Η δέσμευση της πρωτεΐνης που δεσμεύει ΤΑΤΑ μπορεί να επηρεαστεί από την παρουσία κυκλο-dA.
Το οξειδωτικό στρες προκαλεί αστάθεια των μικροδορυφορικών περιοχών (σύντομες διαδοχικές επαναλήψεις). Τα ενεργά μεταλλικά ιόντα οξειδοαναγωγής, οι ρίζες υδροξυλίου αυξάνουν την αστάθεια του μικροδορυφόρου.105 Παρόλο που οι σπασίματα του μονόκλωνου DNA που προκαλούνται από οξειδωτικό τραυματισμό μπορούν εύκολα να γίνουν ανεκτά από τα κύτταρα, οι θραύσεις του δίκλωνου DNA που προκαλούνται από ιονίζουσα ακτινοβολία μπορεί να αποτελούν σημαντική απειλή για την επιβίωση των κυττάρων.106
Η μεθυλίωση σε νησίδες CpG στο DNA είναι ένας σημαντικός επιγενετικός μηχανισμός που μπορεί να οδηγήσει σε γονιδιακή σίγαση. Η οξείδωση του 5-MeCyt σε 5-υδροξυμεθυλουρακίλη (5-OHMeUra) μπορεί να συμβεί μέσω αντιδράσεων απαμίνωσης/οξείδωσης της θυμίνης ή των ενδιάμεσων 5-υδροξυμεθυλκυτοσίνης.107 Εκτός από τη ρύθμιση της έκφρασης γονιδίου, η μεθυλίωση του DNA φαίνεται να επηρεάζει επίσης την οργάνωση της χρωματίνης.108 Ανώμαλα πρότυπα μεθυλίωσης DNA που προκαλούνται από οξειδωτικές επιθέσεις επηρεάζουν επίσης τη δραστηριότητα επιδιόρθωσης του DNA.
Επιδράσεις του οξειδωτικού στρες στα λιπίδια
Τα ROS μπορούν να προκαλέσουν υπεροξείδωση λιπιδίων και να διαταράξουν τη λιπιδική διπλοστιβάδα της μεμβράνης που μπορεί να απενεργοποιήσει υποδοχείς και ένζυμα που συνδέονται με τη μεμβράνη και να αυξήσει τη διαπερατότητα των ιστών. -συνδέσεις.109–110 112-υδροξυ-4-μηνεάλη προκαλεί εξάντληση της ενδοκυτταρικής GSH και επάγει την παραγωγή υπεροξειδίου, 2 ενεργοποιεί τον υποδοχέα του επιδερμικού αυξητικού παράγοντα,113,114 και επάγει την παραγωγή φιμπρονεκτίνης. , έχουν χρησιμοποιηθεί ως έμμεσοι βιοδείκτες του οξειδωτικού στρες και αυξημένα επίπεδα εμφανίστηκαν στο εκπνεόμενο συμπύκνωμα της αναπνοής ή στο υγρό βρογχοκυψελιδικής πλύσης ή στους πνεύμονες ασθενών ή καπνιστών με χρόνια αποφρακτική πνευμονοπάθεια.115–116
Επιδράσεις του οξειδωτικού στρες στις πρωτεΐνες
Το ROS μπορεί να προκαλέσει κατακερματισμό της πεπτιδικής αλυσίδας, αλλαγή του ηλεκτρικού φορτίου των πρωτεϊνών, διασύνδεση πρωτεϊνών και οξείδωση συγκεκριμένων αμινοξέων και ως εκ τούτου να οδηγήσει σε αυξημένη ευαισθησία στην πρωτεόλυση μέσω αποικοδόμησης από συγκεκριμένες πρωτεάσες.120 Τα υπολείμματα κυστεΐνης και μεθειονίνης στις πρωτεΐνες είναι ιδιαίτερα πιο ευαίσθητα στην οξείδωση.121 Η οξείδωση των σουλφυδρυλικών ομάδων ή των υπολειμμάτων μεθειονίνης των πρωτεϊνών προκαλεί αλλαγές διαμόρφωσης, ξεδίπλωμα πρωτεΐνης και αποικοδόμηση. Η οξειδωτική τροποποίηση των ενζύμων έχει αποδειχθεί ότι αναστέλλει τις δραστηριότητές τους.8,121
Σε ορισμένες περιπτώσεις, μπορεί να λάβει χώρα ειδική οξείδωση πρωτεϊνών. Για παράδειγμα, η μεθειονίνη μπορεί να οξειδωθεί με σουλφοξείδιο της μεθειονίνης126 και η φαινυλαλανίνη σε ο-τυροσίνη127. Οι σουλφυδρυλικές ομάδες μπορούν να οξειδωθούν για να σχηματίσουν δισουλφιδικούς δεσμούς· 128 και ομάδες καρβονυλίου μπορούν να εισαχθούν στις πλευρικές αλυσίδες των πρωτεϊνών. Οι ακτίνες γάμμα, η καταλυόμενη από μέταλλο οξείδωση, το HOCl και το όζον μπορούν να προκαλέσουν σχηματισμό καρβονυλικών ομάδων.129
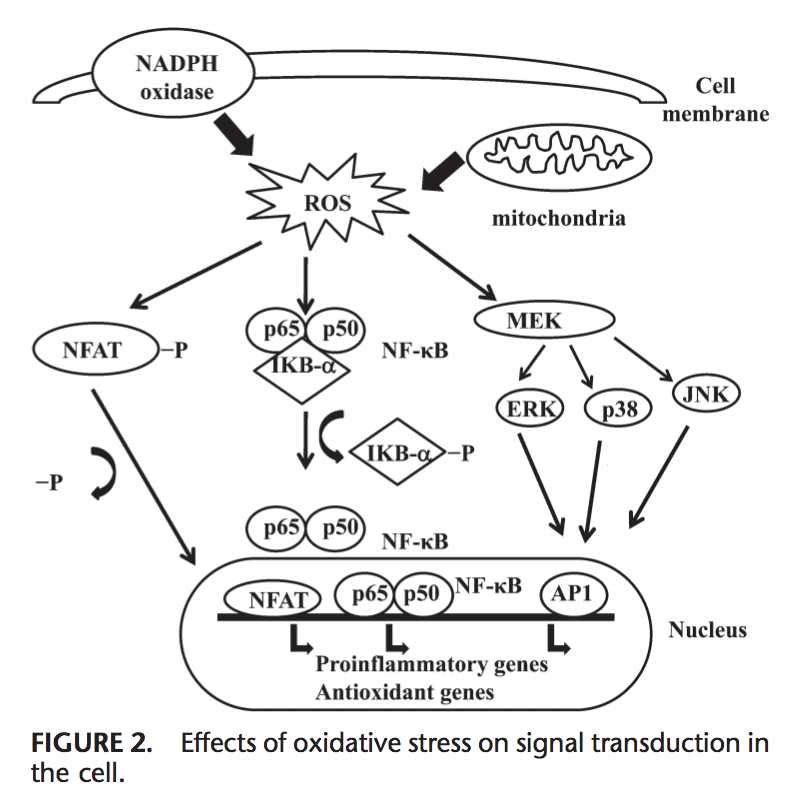
Επιδράσεις του οξειδωτικού στρες στη μεταγωγή σήματος
Το ROS μπορεί να προκαλέσει έκφραση πολλών γονιδίων που εμπλέκονται στη μεταγωγή σήματος. 1,130 Μια υψηλή αναλογία για GSH/GSSG είναι σημαντική για την προστασία του κυττάρου από οξειδωτική βλάβη. Η διαταραχή αυτής της αναλογίας προκαλεί ενεργοποίηση των οξειδοαναγωγικών ευαίσθητων μεταγραφικών παραγόντων, όπως οι NF-kB, AP-1, πυρηνικός παράγοντας ενεργοποιημένων Τ κυττάρων και επαγόμενος από υποξία παράγοντας 1, που εμπλέκονται στη φλεγμονώδη απόκριση. Η ενεργοποίηση των παραγόντων μεταγραφής μέσω ROS επιτυγχάνεται με καταρράκτες μεταγωγής σήματος που μεταδίδουν τις πληροφορίες από το εξωτερικό στο εσωτερικό του κυττάρου. Οι υποδοχείς κινάσης τυροσίνης, οι περισσότεροι από τους υποδοχείς αυξητικού παράγοντα, όπως ο υποδοχέας του επιδερμικού αυξητικού παράγοντα, ο υποδοχέας του αγγειακού ενδοθηλιακού αυξητικού παράγοντα και ο υποδοχέας για τον αυξητικό παράγοντα που προέρχεται από αιμοπετάλια, τις πρωτεϊνικές φωσφατάσες τυροσίνης και τις κινάσες σερίνης/θρεονίνης είναι στόχοι του ROS.131-133 Οι εξωκυτταρικές κινάσες που ρυθμίζονται με σήμα, JNK και p38, που είναι μέλη της οικογένειας πρωτεϊνικών κινασών που ενεργοποιούνται από μιτογόνο και εμπλέκονται σε διάφορες διεργασίες στα κύτταρα, συμπεριλαμβανομένου του πολλαπλασιασμού, της διαφοροποίησης και της απόπτωσης, μπορούν επίσης να ρυθμιστούν από οξειδωτικά.
Υπό συνθήκες οξειδωτικού στρες, τα υπολείμματα κυστεΐνης στη θέση δέσμευσης DNA του c-Jun, ορισμένες υπομονάδες AP-1 και η ανασταλτική κινάση kB υφίστανται αναστρέψιμη S-γλουταθειόλη. Η γλουταρδοξίνη και το TRX έχουν αναφερθεί ότι παίζουν σημαντικό ρόλο στη ρύθμιση των οδών σηματοδότησης ευαίσθητων στην οξειδοαναγωγή, όπως το NF-kB και το AP-1, η ενεργοποιημένη από μιτογόνο πρωτεΐνη κινάση p38 και η JNK.134-137
Το NF-kB μπορεί να ενεργοποιηθεί ως απόκριση στο οξειδωτικό συνθήκες άγχους, όπως ROS, ελεύθερες ρίζες και ακτινοβολία UV.138 Η φωσφορυλίωση του IkB ελευθερώνει το NF-kB και του επιτρέπει να εισέλθει στον πυρήνα για να ενεργοποιήσει τη μεταγραφή γονιδίων.139 Ένας αριθμός κινασών έχει αναφερθεί ότι φωσφορυλιώνει τα IkBs στα υπολείμματα σερίνης. Αυτές οι κινάσες είναι οι στόχοι των οξειδωτικών σημάτων για την ενεργοποίηση του NF-kB.140 Οι αναγωγικοί παράγοντες ενισχύουν τη δέσμευση του NF-kB DNA, ενώ οι οξειδωτικοί παράγοντες αναστέλλουν τη δέσμευση DNA του NF-kB. Το TRX μπορεί να ασκεί 2 αντίθετες δράσεις στη ρύθμιση του NF-kB: στο κυτταρόπλασμα, εμποδίζει την αποικοδόμηση του IkB και αναστέλλει την ενεργοποίηση του NF-kB αλλά ενισχύει τη δέσμευση του NF-kB DNA στον πυρήνα.141 Ενεργοποίηση του NF-kB μέσω αποικοδόμησης που σχετίζεται με την οξείδωση του IkB έχει ως αποτέλεσμα την ενεργοποίηση αρκετών γονιδίων που σχετίζονται με την αντιοξειδωτική άμυνα. Το NF-kB ρυθμίζει την έκφραση πολλών γονιδίων που συμμετέχουν στην ανοσολογική απόκριση, όπως η IL-1b, η IL-6, ο παράγοντας νέκρωσης όγκου-a, η IL-8 και πολλά μόρια προσκόλλησης.142,143 NF-kB ρυθμίζει επίσης την αγγειογένεση και τον πολλαπλασιασμό και διαφοροποίηση των κυττάρων.
Το AP-1 ρυθμίζεται επίσης από την οξειδοαναγωγική κατάσταση. Παρουσία H2O2, ορισμένα μεταλλικά ιόντα μπορούν να προκαλέσουν ενεργοποίηση του AP-1. Η αύξηση της αναλογίας GSH/GSSG ενισχύει τη δέσμευση AP-1 ενώ η GSSG αναστέλλει τη δέσμευση DNA του AP-1.144 Η δέσμευση DNA του ετεροδιμερούς Fos/Jun αυξάνεται με τη μείωση μιας μοναδικής διατηρημένης κυστεΐνης στην περιοχή δέσμευσης DNA καθενός από οι πρωτεΐνες,145 ενώ η δέσμευση DNA του AP-1 μπορεί να ανασταλεί από το GSSG σε πολλούς τύπους κυττάρων, υποδηλώνοντας ότι ο σχηματισμός δισουλφιδικού δεσμού από υπολείμματα κυστεΐνης αναστέλλει τη δέσμευση του AP-1 DNA.146,147 Η μεταγωγή σήματος μέσω οξειδωτικού στρες συνοψίζεται στο Σχήμα 2.
ΣΥΜΠΕΡΑΣΜΑΤΑ
Το οξειδωτικό στρες μπορεί να προκύψει από υπερπαραγωγή ROS από μεταβολικές αντιδράσεις που χρησιμοποιούν οξυγόνο και μετατοπίζουν την ισορροπία μεταξύ οξειδωτικό/αντιοξειδωτικό κατάσταση υπέρ των οξειδωτικών. Τα ROS παράγονται από κυτταρικές μεταβολικές δραστηριότητες και περιβαλλοντικούς παράγοντες, όπως οι ατμοσφαιρικοί ρύποι ή ο καπνός του τσιγάρου. Τα ROS είναι εξαιρετικά αντιδραστικά μόρια λόγω των μη ζευγαρωμένων ηλεκτρονίων στη δομή τους και αντιδρούν με πολλά βιολογικά μακρομόρια στο κύτταρο, όπως υδατάνθρακες, νουκλεϊκά οξέα, λιπίδια και πρωτεΐνες, και μεταβάλλουν τις λειτουργίες τους. Το ROS επηρεάζει επίσης την έκφραση αρκετών γονιδίων μέσω της ρύθμισης προς τα πάνω των ευαίσθητων στην οξειδοαναγωγή παραγόντων μεταγραφής και της αναδιαμόρφωσης της χρωματίνης μέσω της αλλαγής στην ακετυλίωση/αποακετυλίωση ιστόνης. Η ρύθμιση της οξειδοαναγωγικής κατάστασης είναι κρίσιμη για τη βιωσιμότητα των κυττάρων, την ενεργοποίηση, τον πολλαπλασιασμό και τη λειτουργία των οργάνων.
αναφορές:
Αναφορές
1. Valko M, Rhodes CJ, Moncol J, Izakovic M, Mazur M. Ελεύθερες ρίζες, μέταλλα και αντιοξειδωτικά στον καρκίνο που προκαλείται από το οξειδωτικό στρες. Chem Biol Interact. 2006; 160:1–40.
2. Halliwell B, Gutterridge JMC. Ελεύθερες Ρίζες στη Βιολογία και την Ιατρική. 3η έκδ. Νέα Υόρκη: Oxford University Press, 1999.
3. Marnett LJ. Υπεροξείδωση λιπιδίων και βλάβη DNA από μηλονοδιαλδεΰδη. Mutat Res. 1999; 424:83-95.
4. Siems WG, Grune T, Esterbauer H. Σχηματισμός 4-υδροξυνενεάλης κατά τη διάρκεια ισχαιμίας και επαναιμάτωσης λεπτού εντέρου αρουραίου. Life Sci. 1995, 57:785-789.
5. Stadtman ER. Ο ρόλος των οξειδωτικών ειδών στη γήρανση. Curr Med Chem. 2004; 11:1105-1112.
6. Wang MY, Dhingra K, Hittelman WN, Liehr JG, deAndrade M, Li DH. Υποτιθέμενα προϊόντα προσθήκης μηλονοδιαλδεΰδης-DNA που προκαλούνται από υπεροξείδωση λιπιδίων σε ιστούς ανθρώπινου μαστού. Βιοδείκτες επιδημιόλης καρκίνου Προηγ. 1996; 5:705-710.
7. Jenner P. Οξειδωτικό στρες στη νόσο του Πάρκινσον. Ann Neurol. 2003;53: S26–S36.
8. Lyras L, Cairns NJ, Jenner A, Jenner P, Halliwell B. Μια εκτίμηση της οξειδωτικής βλάβης σε πρωτεΐνες, λιπίδια και DNA στον εγκέφαλο από ασθενείς με νόσο Alzheimer. J Neurochem. 1997; 68:2061-2069.
9. Sayre LM, Smith MA, Perry G. Chemistry and biochemistry of oxidative stress in neurodegenerative disease. Curr Med Chem. 2001; 8:721-738.
10. Toshniwal PK, Zarling EJ. Στοιχεία για αυξημένη υπεροξείδωση λιπιδίων στη σκλήρυνση κατά πλάκας. Neurochem Res. 1992; 17:205-207.
11. Dhalla NS, Temsah RM, Netticadan T. Ρόλος οξειδωτικού στρες σε καρδιαγγειακές παθήσεις. J Hypertens. 2000; 18:655-673.
12. Kasparova S, Brezova V, Valko M, Horecky J, Mlynarik V, et al. Μελέτη του οξειδωτικού στρες σε μοντέλο χρόνιας υποαιμάτωσης του εγκεφάλου σε αρουραίο. Neurochem Int. 2005; 46:601-611.
13. Kerr S, Brosnan MJ, McIntyre M, Reid JL, Dominiczak AF, Hamilton CA. Η παραγωγή ανιόντων υπεροξειδίου αυξάνεται σε ένα μοντέλο γενετικής υπέρτασης: ο ρόλος του ενδοθηλίου. Υπέρταση. 1999; 33:1353-1358.
14. Kukreja RC, Hess ML. Το σύστημα ελεύθερων ριζών οξυγόνου: από εξισώσεις μέσω αλληλεπιδράσεων μεμβράνης-πρωτεΐνης έως καρδιαγγειακές βλάβες και προστασία. Cardiovasc Res. 1992; 26:641-655.
15. Asami S, Manabe Η, Miyake J, Tsurudome Υ, Hirano Τ, et al. Το κάπνισμα προκαλεί αύξηση της οξειδωτικής βλάβης του DNA, της 8-υδροξυδεοξυγουανοσίνης, σε μια κεντρική θέση του ανθρώπινου πνεύμονα. Καρκινογένεση. 1997, 18:1763–1766.
16. Andreadis AA, Hazen SL, Comhair SA, Erzurum SC. Οξειδωτικά και νιτρώδη συμβάντα στο άσθμα. Free Radic Biol Med. 2003; 35:213-225.
17. Comhair SA, Ricci KS, Arroliga M, Lara AR, Dweik RA, et al. Συσχέτιση συστηματικής ανεπάρκειας υπεροξειδικής δισμουτάσης με απόφραξη ροής αέρα στο άσθμα. Am J Respir Crit Care Med. 2005; 172:306-313.
18. Comhair SA, Xu W, Ghosh S, Thunnissen FB, Almasan Α, et al. Απενεργοποίηση υπεροξειδίου δισμουτάσης στην παθοφυσιολογία της ασθματικής αναδιαμόρφωσης και αντιδραστικότητας των αεραγωγών. Am J Pathol. 2005; 166:663-674.
19. Dut R, Dizdar EA, Birben E, Sackesen C, Soyer OU, Besler T, Kalayci O. Το οξειδωτικό στρες και οι καθοριστικοί παράγοντες του στους αεραγωγούς παιδιών με άσθμα. Αλλεργία. 2008; 63:1605–1609.
20. Ercan Η, Birben Ε, Dizdar ΕΑ, Keskin Ο, Karaaslan C, et αϊ. Οξειδωτικό στρες και γενετικοί και επιδημιολογικοί καθοριστικοί παράγοντες της οξειδωτικής βλάβης στο παιδικό άσθμα. J Allergy Clin Immunol. 2006; 118:1097-1104.
21. Fitzpatrick AM, Teague WG, Holguin F, Yeh M, Brown LA. Πρόγραμμα Έρευνας Σοβαρού Άσθματος. Η ομοιόσταση της γλουταθειόνης των αεραγωγών μεταβάλλεται σε παιδιά με σοβαρό άσθμα: στοιχεία για οξειδωτικό στρες. J Allergy Clin Immunol. 2009; 123:146-152.
22. Miller DM, Buettner GR, Aust SD. Μέταλλα μεταπτώσεως ως καταλύτες αντιδράσεων «αυτοξείδωσης». Free Radic Biol Med. 1990; 8:95-108.
23. Dupuy C, Virion Α, Ohayon R, Kaniewski J, Dème D, Pommier J. Μηχανισμός σχηματισμού υπεροξειδίου του υδρογόνου που καταλύεται από οξειδάση NADPH στη μεμβράνη πλάσματος του θυρεοειδούς. J Biol Chem. 1991; 266:3739-3743.
24. Granger DN. Ο ρόλος της οξειδάσης της ξανθίνης και των κοκκιοκυττάρων στην ισχαιμική αιμάτωση. Am J Physiol. 1988;255:H1269-H1275.
25. Fenton HJH. Οξείδωση τρυγικού οξέος παρουσία σιδήρου. J Chem Soc. 1984, 65:899-910.
26. Haber F, Weiss JJ. Η καταλυτική αποσύνθεση του υπεροξειδίου του υδρογόνου από άλατα σιδήρου. Proc R Soc Lond Ser A. 1934· 147:332–351.
27. Liochev SI, Fridovich I. The Haber–Weiss κυκλοφόρησε70 χρόνια αργότερα: μια εναλλακτική άποψη. Redox Rep. 2002; 7:55–57.
28. Klebanoff SJ. Μυελοϋπεροξειδάση: φίλος και εχθρός. J Leukoc Biol. 2005; 77:598-625.
29. Whiteman Μ, Jenner Α, Halliwell Β. Τροποποιήσεις βάσης που προκαλούνται από υποχλωριώδες οξύ σε απομονωμένο DNA θύμου μόσχου. Chem Res Toxicol. 1997, 10:1240-1246.
30. Kulcharyk PA, Heinecke JW. Το υποχλωριώδες οξύ που παράγεται από το σύστημα μυελοϋπεροξειδάσης των ανθρώπινων φαγοκυττάρων προκαλεί ομοιοπολικούς διασταυρούμενους δεσμούς μεταξύ DNA και πρωτεΐνης. Βιοχημεία. 2001; 40:3648-3656.
31. Brennan ML, Wu W, Fu X, Shen Z, Song W, et αϊ. Μια ιστορία δύο αντιπαραθέσεων: ορισμός τόσο του ρόλου των υπεροξειδασών στο σχηματισμό νιτροτυροσίνης in vivo με χρήση ηωσινοφίλων υπεροξειδάσης και ποντικών με έλλειψη μυελοϋπεροξειδάσης, όσο και της φύσης των ειδών αντιδραστικού αζώτου που δημιουργούνται από υπεροξειδάση. J Biol Chem. 2002;277:17415–17427.
32. Denzler KL, Borchers ΜΤ, Crosby JR, Cieslewicz G, Hines ΕΜ, et αϊ. Η εκτεταμένη αποκοκκίωση των ηωσινόφιλων και η οξείδωση των πρωτεϊνών των αεραγωγών με τη μεσολάβηση υπεροξειδάσης δεν συμβαίνουν σε ένα μοντέλο πρόκλησης ωοαλβουμίνης ποντικού πνευμονικής φλεγμονής. J Immunol. 2001; 167:1672–1682.
33. van Dalen CJ, Winterbourn CC, Senthilmohan R, Kettle AJ. Νιτρώδες ως υπόστρωμα και αναστολέας της μυελοϋπεροξειδάσης. Επιπτώσεις για τη νίτρωση και την παραγωγή υποχλωριώδους οξέος σε σημεία φλεγμονής. J Biol Chem. 2000;275:11638–11644.
34. Wood LG, Fitzgerald DA, Gibson PG, Cooper DM, Garg ML. Η υπεροξείδωση των λιπιδίων, όπως προσδιορίζεται από τις ισοπροστάνες του πλάσματος, σχετίζεται με τη σοβαρότητα της νόσου στο ήπιο άσθμα. Λιπίδια. 2000; 35:967-974.
35. Montuschi P, Corradi M, Ciabattoni G, Nightingale J, Kharitonov SA, Barnes PJ. Αυξημένη 8-ισοπροστάνη, δείκτης οξειδωτικού στρες, στο εκπνεόμενο συμπύκνωμα ασθενών με άσθμα. Am J Respir Crit Care Med. 1999; 160:216-220.
36. Church DF, Pryor WA. Η χημεία των ελεύθερων ριζών του καπνού του τσιγάρου και οι τοξικολογικές της επιπτώσεις. Περιβαλλοντική Προοπτική Υγείας. 1985; 64:111-126.
37. Hiltermann JT, Lapperre TS, van Bree L, Steerenberg ΡΑ, Brahim JJ, et αϊ. Η φλεγμονή που προκαλείται από το όζον αξιολογείται σε υγρό πτυέλων και βρογχικής πλύσης από ασθματικούς: ένα νέο μη επεμβατικό εργαλείο σε επιδημιολογικές μελέτες για την ατμοσφαιρική ρύπανση και το άσθμα. Free Radic Biol Med. 1999; 27:1448-1454.
38. Nightingale JA, Rogers DF, Barnes PJ. Επίδραση του εισπνεόμενου όζοντος στο εκπνεόμενο μονοξείδιο του αζώτου, την πνευμονική λειτουργία και τα επαγόμενα πτύελα σε φυσιολογικά και ασθματικά άτομα. Θώρακας. 1999; 54:1061-1069.
39. Cho AK, Sioutas C, Miguel AH, Kumagai Y, Schmitz DA, et al. Δραστηριότητα οξειδοαναγωγής αιωρούμενων σωματιδίων σε διαφορετικές τοποθεσίες στη λεκάνη του Λος Άντζελες. Environ Res. 2005; 99:40–47.
40. Comhair SA, Thomassen MJ, Erzurum SC. Διαφορική επαγωγή εξωκυτταρικής υπεροξειδάσης γλουταθειόνης και συνθάσης νιτρικού οξειδίου 2 σε αεραγωγούς υγιών ατόμων που εκτίθενται σε 100% Ο(2) ή καπνό τσιγάρου. Am J Respir Cell ΜοΙ Biol. 2000; 23:350-354.
41. Matthay MA, Geiser T, Matalon S, Ischiropoulos H. Οξειδωτικά μεσολαβούμενη πνευμονική βλάβη στο σύνδρομο οξείας αναπνευστικής δυσχέρειας. Crit Care Med. 1999; 27:2028–2030.
42. Biaglow JE, Mitchell JB, Held K. Η σημασία του υπεροξειδίου και του υπεροξειδίου στην απόκριση ακτίνων Χ. Int J Radiat Oncol Biol Phys. 1992; 22:665-669.
43. Chiu SM, Xue LY, Friedman LR, Oleinick NL. Ευαισθητοποίηση θέσεων προσάρτησης πυρηνικής μήτρας σε ιονίζουσα ακτινοβολία με μεσολάβηση ιόντων χαλκού. Βιοχημεία. 1993; 32:6214-6219.
44. Narayanan PK, Goodwin EH, Lehnert BE. Τα σωματίδια άλφα ξεκινούν τη βιολογική παραγωγή ανιόντων υπεροξειδίου και υπεροξειδίου του υδρογόνου στα ανθρώπινα κύτταρα. Cancer Res. 1997, 57:3963-3971.
45. Tuttle SW, Varnes ME, Mitchell JB, Biaglow JE. Ευαισθησία σε χημικά οξειδωτικά και ακτινοβολία σε κυτταρικές σειρές CHO με ανεπάρκεια στη δραστηριότητα του κύκλου οξειδωτικής πεντόζης. Int J Radiat Oncol Biol Phys. 1992, 22: 671-675.
46. Guo G, Yan-Sanders Y, Lyn-Cook BD, Wang Τ, Tamae D, et αϊ. Μαγγάνιο
γονιδιακή έκφραση με μεσολάβηση υπεροξειδίου δισμουτάσης σε επαγόμενη από ακτινοβολία
προσαρμοστικές απαντήσεις. ΜοΙ Cell ΒίοΙ. 2003; 23:2362-2378.
47. Azzam EI, de Toledo SM, Spitz DR, Little JB. Οξειδωτικός μεταβολισμός
ρυθμίζει τη μεταγωγή σήματος και το σχηματισμό μικροπυρήνων σε παρευρισκόμενο
κύτταρα από φυσιολογικούς ανθρώπινους ινοβλάστες που ακτινοβολήθηκαν με σωματίδιο α. Cancer Res.
2002, 62: 5436-5442.
48. Leach JK, Van Tuyle G, Lin PS, Schmidt-Ullrich R, Mikkelsen RB.
Προκαλούμενη από ιονίζουσα ακτινοβολία, εξαρτώμενη από μιτοχόνδρια παραγωγή αντιδραστικών
οξυγόνο/άζωτο. Cancer Res. 2001; 61:3894-3901.
49. Dent P, Yacoub A, Fisher PB, Hagan MP, Grant S. MAPK μονοπάτια σε
αποκρίσεις ακτινοβολίας. Ογκογόνο. 2003; 22:5885–5896.
50. Wei SJ, Botero Α, Hirota Κ, Bradbury CM, Markovina S, et αϊ. Θειορεδοξίνη
Η πυρηνική μετατόπιση και η αλληλεπίδραση με τον οξειδοαναγωγικό παράγοντα-1 ενεργοποιεί τον μεταγραφικό παράγοντα AP-1 ως απόκριση στην ιονίζουσα ακτινοβολία. Cancer Res. 2000; 60:6688-6695.
51. Cadet J, Douki T, Gasparutto D, Ravanat JL. Οξειδωτικές βλάβες στο DNA: σχηματισμός, μέτρηση και βιοχημικά χαρακτηριστικά. Mutat Res. 2003; 531:5-23.
52. Yokoya A, Cunniffe SM, O'Neill P. Επίδραση της ενυδάτωσης στην επαγωγή θραυσμάτων κλώνου και βλαβών βάσης σε φιλμ πλασμιδικού DNA με γαμραδιασμό. J Am Chem Soc. 2002; 124:8859–8866.
53. Janssen YM, Van Houten B, Borm PJ, Mossman BT. Αποκρίσεις κυττάρων και ιστών σε οξειδωτική βλάβη. Lab Invest. 1993; 69:261-274.
54. Iwanaga Μ, Mori Κ, Iida Τ, Urata Υ, Matsuo Τ, et αϊ. Εξαρτημένη από τον πυρηνικό παράγοντα κάπα Β επαγωγή συνθετάσης γ-γλουταμυλοκυστεΐνης με ιονίζουσα ακτινοβολία σε κύτταρα ανθρώπινου γλοιοβλαστώματος T98G. Free Radic Biol Med. 1998, 24:1256-1268.
55. Stohs SJ, Bagchi D. Οξειδωτικοί μηχανισμοί στην τοξικότητα των μεταλλικών ιόντων. Free Radic Biol Med. 1995; 18:321-336.
56. Leonard SS, Harris GK, Shi X. Metal-induced oxidative stress and signal transduction. Free Radic Biol Med. 2004; 37:1921–1942.
57. Shi H, Shi X, Liu KJ. Οξειδωτικός μηχανισμός τοξικότητας και καρκινογένεσης αρσενικού. ΜοΙ Cell Biochem. 2004; 255:67-78.
58. Pi J, Horiguchi S, Sun Y, Nikaido M, Shimojo N, Hayashi T. Ένας πιθανός μηχανισμός για την εξασθένηση του σχηματισμού μονοξειδίου του αζώτου που προκαλείται από παρατεταμένη στοματική έκθεση σε αρσενικό σε κουνέλια. Free Radic Biol Med.2003;35:102–113.
59. Rin K, Kawaguchi K, Yamanaka K, Tezuka M, Oku N, Okada S. Οι θραύσεις των κλώνων DNA που προκαλούνται από το διμεθυλαρσινικό οξύ, έναν μεταβολίτη ανόργανων αρσενικών, ενισχύονται έντονα από τις ρίζες ανιόντων υπεροξειδίου. Biol Pharm Bull. 1995; 18:45–58.
60. Waalkes MP, Liu J, Ward JM, Diwan LA. Μηχανισμοί στους οποίους βασίζεται η καρκινογένεση του αρσενικού: υπερευαισθησία ποντικών που εκτέθηκαν σε ανόργανο αρσενικό κατά τη διάρκεια της κύησης. Τοξικολογία. 2004; 198:31–38.
61. Schiller CM, Fowler BA, Woods JS. Επιδράσεις του αρσενικού στην ενεργοποίηση της πυροσταφυλικής αφυδρογονάσης. Περιβαλλοντική Προοπτική Υγείας. 1977; 19:205-207.
62. Monterio HP, Bechara EJH, Abdalla DSP. Εμπλοκή ελεύθερων ριζών σε νευρολογικές πορφυρίες και δηλητηρίαση από μόλυβδο. ΜοΙ Cell Biochem. 1991; 103:73-83.
63. Tripathi RM, Raghunath R, Mahapatra S. Μόλυβδος αίματος και η επίδρασή του στα επίπεδα Cd, Cu, Zn, Fe και αιμοσφαιρίνης των παιδιών. Sci Total Environ. 2001; 277:161-168.
64. Nehru B, Dua R. Η επίδραση του διαιτητικού σεληνίου στη νευροτοξικότητα του μολύβδου. J Environ Pathol Toxicol Oncol. 1997; 16:47-50.
65. Reid TM, Feig DI, Loeb LA. Μεταλλαξιγένεση από ρίζες οξυγόνου που προκαλούνται από μέταλλα. Περιβαλλοντική Προοπτική Υγείας. 1994, 102 (suppl 3): 57–61.
66. Kinnula VL, Crapo JD. Δισμουτάσες υπεροξειδίου στους πνεύμονες και σε ασθένειες των πνευμόνων του ανθρώπου. Am J Respir Crit Care Med. 2003, 167:1600–1619.
67. Kinnula VL. Παραγωγή και αποικοδόμηση μεταβολιτών οξυγόνου κατά τη διάρκεια φλεγμονωδών καταστάσεων στον ανθρώπινο πνεύμονα. Το φάρμακο Curr στοχεύει στη φλεγμονώδη αλλεργία. 2005; 4:465-470.
68. Zelko IN, Mariani TJ, Folz RJ. Πολυγονιδιακή οικογένεια δισμουτάσης υπεροξειδίου: σύγκριση των δομών, της εξέλιξης και της έκφρασης των γονιδίων CuZn-SOD (SOD1), Mn-SOD (SOD2) και EC-SOD (SOD3). Free Radic Biol Med. 2002; 33:337-349.
69. Kirkman HN, Rolfo M, Ferraris AM, Gaetani GF. Μηχανισμοί προστασίας καταλάσης από NADPH. Κινητική και στοιχειομετρία. J Biol Chem. 1999;274:13908–13914.
70. Flohé L. υπεροξειδάση γλουταθειόνης. Basic Life Sci. 1988, 49:663-668.
71. Άρθουρ JR. Οι υπεροξειδάσες της γλουταθειόνης. Cell ΜοΙ Life Sci. 2000, 57:1825–1835.
72. Chu FF, Doroshow JH, Esworthy RS. Έκφραση, χαρακτηρισμός και κατανομή στους ιστούς μιας νέας κυτταρικής υπεροξειδάσης γλουταθειόνης που εξαρτάται από το σελήνιο, GSHPx-GI. J Biol Chem. 1993, 268:2571-2576.
73. Comhair SA, Bhathena PR, Farver C, Thunnissen FB, Erzurum SC. Επαγωγή εξωκυτταρικής υπεροξειδάσης γλουταθειόνης σε ασθματικούς πνεύμονες: στοιχεία για οξειδοαναγωγική ρύθμιση της έκφρασης σε επιθηλιακά κύτταρα ανθρώπινου αεραγωγού. FASEB J. 2001· 15:70–78.
74. Gromer S, Urig S, Becker K. The thioredoxin systemdfrom Science to Clinic. Med Res Rev. 2004; 24:40–89.
75. Kinnula VL, Lehtonen S, Kaarteenaho-Wiik R, Lakari Ε, Pääkkö Ρ, et αϊ. Κυτταρική ειδική έκφραση υπεροξιρεδοξινών σε ανθρώπινο πνεύμονα και πνευμονική σαρκοείδωση. Θώρακας. 2002; 57:157-164.
76. Dubuisson Μ, Vander Stricht D, Clippe A, Etienne F, Nauser Τ, et al. Η ανθρώπινη υπεροξιρεδοξίνη 5 είναι μια αναγωγάση υπεροξυνιτρώδους. FEBS Lett. 2004; 571:161-165.
77. Holmgren Α. Αντιοξειδωτική λειτουργία συστημάτων θειορεδοξίνης και γλουταροξίνης. Σήμα αντιοξειδωτικής οξειδοαναγωγής. 2000; 2:811-820.
78. Dickinson DA, Forman HJ. Γλουταθειόνη σε άμυνα και σηματοδότηση: μαθήματα από μια μικρή θειόλη. Ann NY Acad Sci. 2002; 973:488-504.
79. Sies Η. Γλουταθειόνη και ο ρόλος της στις κυτταρικές λειτουργίες. Free Radic Biol Med. 1999; 27:916-921.
80. Ladner JE, Parsons JF, Rife CL, Gilliland GL, Armstrong RN. Παράλληλες εξελικτικές οδοί για τρανσφεράσες γλουταθειόνης: δομή και μηχανισμός του ενζύμου κάπα της μιτοχονδριακής τάξης rGSTK1-1. Βιοχημεία. 2004; 43:52-61.
81. Robinson A, Huttley GA, Booth HS, Board PG. Μελέτες μοντελοποίησης και βιοπληροφορικής της ανθρώπινης τρανσφεράσης γλουταθειόνης κατηγορίας κάπα προβλέπουν μια νέα τρίτη οικογένεια τρανσφερασών με ομολογία με τις προκαρυωτικές 2-υδροξυχρωμενο-2-καρβοξυλικές ισομεράσες. Biochem J. 2004; 379:541-552.
82. Jakobsson PJ, Morgenstern R, Mancini J, Ford-Hutchinson A, Persson B. Κοινά δομικά χαρακτηριστικά της ευρέως διαδεδομένης υπεροικογένειας πρωτεϊνών που σχετίζονται με τη μεμβράνη με εξαιρετικά αποκλίνουσες λειτουργίες στο μεταβολισμό των εικοσανοειδών και της γλουταθειόνης. Protein Sci. 1999; 8:689-692.
83. Hayes JD, Pulford DJ. Η οικογένεια υπεργονιδίων S-τρανσφεράσης της γλουταθειόνης: ρύθμιση της GST και η συμβολή των ισοενζύμων στη χημειοπροστασία του καρκίνου και στην αντοχή στα φάρμακα. Crit Rev Biochem ΜοΙ Biol. 1995; 30:445-600.
84. Armstrong RN. Δομή, καταλυτικός μηχανισμός και εξέλιξη των τρανσφερασών γλουταθειόνης. Chem Res Toxicol. 1997; 10:2-18.
85. Hayes JD, McLellan LI. Η γλουταθειόνη και τα εξαρτώμενα από τη γλουταθειόνη ένζυμα αντιπροσωπεύουν μια συντονισμένα ρυθμισμένη άμυνα ενάντια στο οξειδωτικό στρες. Free Radic Res. 1999; 31:273-300.
86. Sheehan D, Meade G, Foley VM, Dowd CA. Δομή, λειτουργία και εξέλιξη τρανσφερασών γλουταθειόνης: επιπτώσεις για την ταξινόμηση μελών μη θηλαστικών μιας αρχαίας υπεροικογένειας ενζύμων. Biochem J. 2001; 360:1-16.
87. Cho SG, Lee YH, Park HS, Ryoo K, Kang KW, et al. Η γλουταθειόνη S-τρανσφεράση Mu ρυθμίζει τα σήματα που ενεργοποιούνται από το στρες καταστέλλοντας την κινάση 1 που ρυθμίζει το σήμα απόπτωσης. J Biol Chem. 2001;276:12749–12755.
88. Dorion S, Lambert Η, Landry J. Η ενεργοποίηση της οδού σηματοδότησης p38 από θερμικό σοκ περιλαμβάνει τη διάσταση της S-τρανσφεράσης της γλουταθειόνης Mu από το Ask1. J Biol Chem. 2002; 277:30792–30797.
89. Adler V, Yin Z, Fuchs SY, Benezra Μ, Rosario L, et αϊ. Ρύθμιση σηματοδότησης JNK από GSTp. EMBO J. 1999; 18:1321-1334.
90. Manevich Υ, Feinstein SI, Fisher ΑΒ. Η ενεργοποίηση του αντιοξειδωτικού ενζύμου 1-CYS υπεροξιρεδοξίνη απαιτεί γλουταθειονυλίωση που προκαλείται από ετεροδιμερισμό με pGST. Proc Natl Acad Sci US A. 2004, 101:3780–3785.
91. Μπάνκερ VW. Ελεύθερες ρίζες, αντιοξειδωτικά και γήρανση. Med Lab Sci. 1992;49:299-312.
92. Mezzetti A, Lapenna D, Romano F, Costantini F, Pierdomenico SD, et al. Το συστηματικό οξειδωτικό στρες και η σχέση του με την ηλικία και την ασθένεια. J Am Geriatr Soc. 1996, 44:823-827.
93. White E, Shannon JS, Patterson RE. Σχέση μεταξύ βιταμίνης και
χρήση συμπληρωμάτων ασβεστίου και καρκίνο του παχέος εντέρου. Βιοδείκτες επιδημιόλης καρκίνου Προηγ. 1997; 6:769-774.
94. Masella R, Di Benedetto R, Vari R, Filesi C, Giovannini C. Νέοι μηχανισμοί φυσικών αντιοξειδωτικών ενώσεων σε βιολογικά συστήματα: εμπλοκή της γλουταθειόνης και των ενζύμων που σχετίζονται με τη γλουταθειόνη. J Nutr Biochem. 2005; 16:577-586.
95. Curello S, Ceconi C, Bigoli C, Ferrari R, Albertini A, Guarnieri C. Αλλαγές στην κατάσταση της καρδιακής γλουταθειόνης μετά από ισχαιμία και επαναιμάτωση. Experientia. 1985; 41:42-43.
96. El-Agamey A, Lowe GM, McGarvey DJ, Mortensen A, Phillip DM, Truscott TG. Χημεία ριζών καροτενοειδών και αντιοξειδωτικές/προοξειδωτικές ιδιότητες. Arch Biochem Biophys. 2004; 430:37-48.
97. Rice-Evans CA, Sampson J, Bramley ΡΜ, Holloway DE. Γιατί περιμένουμε τα καροτενοειδή να είναι αντιοξειδωτικά in vivo; Free Radic Res. 1997; 26:381-398.
98. Niles RM. Μονοπάτια σηματοδότησης στη χημειοπρόληψη των ρετινοειδών και στη θεραπεία του καρκίνου. Mutat Res. 2004; 555:81–96.
99. Donato LJ, Noy N. Καταστολή της ανάπτυξης καρκινώματος του μαστού από το ρετινοϊκό οξύ: τα προαποπτωτικά γονίδια είναι στόχοι για τη σηματοδότηση του υποδοχέα ρετινοϊκού οξέος και της κυτταρικής πρωτεΐνης II που δεσμεύει το ρετινοϊκό οξύ. Cancer Res. 2005; 65:8193-8199.
100. Niizuma Η, Nakamura Υ, Ozaki Τ, Nakanishi Η, Ohira Μ, et αϊ. Το Bcl-2 είναι ένας βασικός ρυθμιστής για τον επαγόμενο από το ρετινοϊκό οξύ αποπτωτικό κυτταρικό θάνατο στο νευροβλάστωμα. Ογκογόνο. 2006; 25:5046-5055.
101. Dalton ΤΡ, Shertzer HG, Puga Α. Ρύθμιση γονιδιακής έκφρασης με αντιδραστικό οξυγόνο. Ann Rev Pharmacol Toxicol. 1999; 39:67-101.
102. Σκανδάλιος Ι.Γ. Γονιδιωματικές αποκρίσεις στο οξειδωτικό στρες. Στο: Meyers RA, ed. Εγκυκλοπαίδεια Μοριακής Κυτταρικής Βιολογίας και Μοριακής Ιατρικής. Τόμος 5. 2η έκδ. Weinheim, Γερμανία: Wiley-VCH; 2004: 489–512.
103. Ghosh R, Mitchell DL. Επίδραση της οξειδωτικής βλάβης του DNA σε στοιχεία προαγωγέα στη δέσμευση του μεταγραφικού παράγοντα. Nucleic Acids Res. 1999; 27:3213-3218.
104. Marietta C, Gulam H, Brooks PJ. Μια μεμονωμένη βλάβη 8, 50-κυκλο-20-δεοξυαδενοσίνης σε κουτί TATA αποτρέπει τη δέσμευση της πρωτεΐνης δέσμευσης ΤΑΤΑ και μειώνει έντονα τη μεταγραφή in vivo. Επιδιόρθωση DNA (Amst). 2002; 1:967-975.
105. Jackson AL, Chen R, Loeb LA. Επαγωγή μικροδορυφορικής αστάθειας
από οξειδωτική βλάβη του DNA. Proc Natl Acad Sci US A. 1998;95:12468–12473.
106. Caldecott KW. Αλληλεπιδράσεις πρωτεΐνης-πρωτεΐνης κατά την επιδιόρθωση μονόκλωνου DNA θηλαστικών. Biochem Soc Trans. 2003; 31:247-251.
107. Cooke MS, Evans MD, Dizdaroglu M, Lunec J. Οξειδωτική βλάβη DNA: μηχανισμοί, μετάλλαξη και ασθένεια. FASEB J. 2003· 17:1195–1214.
108. Jones PL, Wolffe AP. Σχέσεις μεταξύ της οργάνωσης της χρωματίνης και της μεθυλίωσης του DNA στον προσδιορισμό της γονιδιακής έκφρασης. Semin Cancer Biol. 1999; 9:339-347.
109. Girotti AW. Μηχανισμοί υπεροξείδωσης λιπιδίων. J Free Radic Biol Med. 1985; 1:87-95.
110. Siu GM, Draper HH. Μεταβολισμός μηλοναλδεΰδης in vivo και in vitro. Λιπίδια. 1982; 17:349-355.
111. Esterbauer Η, Koller Ε, Slee RG, Koster JF. Πιθανή συμμετοχή του προϊόντος υπεροξείδωσης λιπιδίων 4-υδροξυνενεάλη στον σχηματισμό φθοριζόντων χρωμολιπιδίων. Biochem J. 1986, 239:405-409.
112. Hagihara M, Nishigaki I, Maseki M, Yagi K. Αλλαγές που εξαρτώνται από την ηλικία στα επίπεδα υπεροξειδίου των λιπιδίων στα κλάσματα λιποπρωτεϊνών του ανθρώπινου ορού. J Gerontol. 1984; 39:269-272.
113. Keller JN, Mark RJ, Bruce AJ, Blanc Ε, Rothstein JD, et al. 4- Η υδροξυνενεάλη, ένα αλδεϋδικό προϊόν της υπεροξείδωσης των λιπιδίων της μεμβράνης, βλάπτει τη μεταφορά γλουταμικού και τη μιτοχονδριακή λειτουργία στα συναπτοσώματα. Νευροεπιστήμη. 1997, 806:85–96.
114. Uchida K, Shiraishi M, Naito Y, Torii Y, Nakamura Y, Osawa T. Ενεργοποίηση μονοπατιών σηματοδότησης στρες από το τελικό προϊόν της υπεροξείδωσης λιπιδίων. Η 4-υδροξυ-2-νενεάλη είναι ένας πιθανός επαγωγέας της παραγωγής ενδοκυτταρικού υπεροξειδίου. J Biol Chem. 1999; 274:2234-2242.
115. Suc I, Meilhac Ο, Lajoie-Mazenc I, Vandaele J, Jurgens G, Salvayre R, Negre-Salvayre Α. Ενεργοποίηση υποδοχέα EGF από οξειδωμένη LDL. FASEB J. 1998, 12:665-671.
116. Tsukagoshi H, Kawata T, Shimizu Y, Ishizuka T, Dobashi K, Mori M. Το 4-Hydroxy-2-nonenal ενισχύει την παραγωγή φιμπρονεκτίνης από ανθρώπινους πνευμονικούς ινοβλάστες IMR-90 εν μέρει μέσω ενεργοποίησης εξωκυτταρικού σηματοδοτικού υποδοχέα που συνδέεται με επιδερμικό αυξητικό παράγοντα ρυθμισμένη οδό κινάσης p44/42. Toxicol Appl Pharmacol. 2002; 184:127-135.
117. Montuschi P, Collins JV, Ciabattoni G, Lazzeri N, Corradi M, Kharitonov SA, Barnes PJ. Η εκπνεόμενη 8-ισοπροστάνη ως in vivo βιοδείκτης του οξειδωτικού στρες στους πνεύμονες σε ασθενείς με ΧΑΠ και υγιείς καπνιστές. Am J Respir Crit Care Med. 2000; 162:1175-1177.
118. Morrison D, Rahman I, Lannan S, MacNee W. Επιθηλιακή διαπερατότητα, φλεγμονή και οξειδωτικό στρες στους εναέριους χώρους των καπνιστών. Am J Respir Crit Care Med. 1999; 159:473-479.
119. Nowak D, Kasielski M, Antczak A, Pietras T, Bialasiewicz P. Αυξημένη περιεκτικότητα σε δραστικές με θειοβαρβιτουρικό οξύ ουσίες και υπεροξείδιο του υδρογόνου στο εκπνεόμενο συμπύκνωμα αναπνοής ασθενών με σταθερή χρόνια αποφρακτική πνευμονοπάθεια: καμία σημαντική επίδραση του καπνίσματος τσιγάρου. Respir Med. 1999; 93:389-396.
120. Kelly FJ, Mudway IS. Οξείδωση πρωτεϊνών στη διεπιφάνεια αέρα-πνεύμονα. Αμινοξέα. 2003; 25:375-396.
121. Dean RT, Roberts CR, Jessup W. Fragmentation of extracellular and intracellular polypeptides by free radicals. Prog Clin Biol Res. 1985, 180:341-350.
122. Keck RG. Η χρήση του υδροϋπεροξειδίου του t-βουτυλίου ως ανιχνευτή για την οξείδωση μεθειονίνης σε πρωτεΐνες. Anal Biochem. 1996; 236:56-62.
123. Davies KJ. Βλάβη και αποικοδόμηση της πρωτεΐνης από τις ρίζες οξυγόνου. I. Γενικές πτυχές. J Biol Chem. 1987, 262:9895–9901.
124. Stadtman ER. Οξείδωση πρωτεϊνών που καταλύεται από ιόντα μετάλλου: βιοχημικός μηχανισμός και βιολογικές συνέπειες. Free Radic Biol Med.
1990, 9: 315-325.
125. Fucci L, Oliver CN, Coon MJ, Stadtman ER. Απενεργοποίηση βασικών μεταβολικών ενζύμων από αντιδράσεις οξείδωσης μικτής λειτουργίας: πιθανή επίπτωση στον κύκλο εργασιών και τη γήρανση των πρωτεϊνών. Proc Natl Acad Sci US A. 1983, 80:1521–1525.
126. Stadtman ER, Moskovitz J, Levine RL. Οξείδωση υπολειμμάτων μεθειονίνης πρωτεϊνών: βιολογικές συνέπειες. Σήμα αντιοξειδωτικής οξειδοαναγωγής. 2003; 5:577-582.
127. Stadtman ER, Levine RL. Οξείδωση ελεύθερων αμινοξέων και υπολειμμάτων αμινοξέων στις πρωτεΐνες με τη μεσολάβηση ελεύθερων ριζών. Αμινοξέα. 2003; 25:207-218.
128. Stadtman ER. Οξείδωση πρωτεϊνών στη γήρανση και σε ασθένειες που σχετίζονται με την ηλικία. Ann NY Acad Sci. 2001; 928:22-38.
129. Shacter E. Ποσοτικοποίηση και σημασία της οξείδωσης πρωτεϊνών σε βιολογικά δείγματα. Drug Metab Rev. 2000; 32:307-326.
130. Poli G, Leonarduzzi G, Biasi F, Chiarpotto E. Oxidative stress and cell signalling. Curr Med Chem. 2004; 11:1163-1182.
131. Neufeld G, Cohen Τ, Gengrinovitch S, Poltorak Ζ. Vascular endothelial growth factor (VEGF) and its receptors. FASEB J. 1999, 13:9–22.
132. Sundaresan M, Yu ZX, Ferrans VJ, Sulciner DJ, Gutkind JS, et αϊ. Ρύθμιση της παραγωγής αντιδραστικών ειδών οξυγόνου σε ινοβλάστες από το Rac1. Biochem J. 1996; 318:379-382.
133. Sun T, Oberley LW. Ρύθμιση οξειδοαναγωγής μεταγραφικών ενεργοποιητών. Free Radic Biol Med. 1996; 21:335-348.
134. Klatt P, Molina EP, De Lacoba MG, Padilla CA, Martinez-Galesteo E, Barcena JA, Lamas S. Οξειδοαναγωγική ρύθμιση της δέσμευσης DNA c-Jun με αναστρέψιμη S-γλουταθειόλη. FASEB J. 1999, 13:1481–1490.
135. Reynaert NL, Ckless K, Guala AS, Wouters EF, van der Vliet A, Janssen Heininger
ΥΜ. In situ ανίχνευση S-γλουταθειονυλιωμένων πρωτεϊνών μετά από παραγωγοποίηση κυστεΐνης που καταλύεται από γλουταρεξίνη-1. Biochim Biophys Acta. 2006; 1760:380-387.
136. Reynaert NL, Wouters EF, Janssen-Heininger YM. Τροποποίηση της γλουταρεξίνης-1
έκφραση σε μοντέλο ποντικού αλλεργικής νόσου των αεραγωγών. Am J Respir Cell ΜοΙ Biol. 2007; 36:147-151.
137. Filomeni G, Rotilio G, Ciriolo MR. Κυτταρική σηματοδότηση και οξειδοαναγωγικό σύστημα γλουταθειόνης. Biochem Pharmacol. 2002; 64:1057-1064.
138. Pande V, Ramos MJ. Μοριακή αναγνώριση της 15-δεοξυδέλτα (12,14) προσταγλανδίνης J(2) από τον πυρηνικό παράγοντα-κάπα Β και άλλες κυτταρικές πρωτεΐνες. Bioorg Med Chem Lett. 2005; 15:4057-4063.
139. Πέρκινς ΝΔ. Ενσωμάτωση μονοπατιών κυτταρικής σηματοδότησης με τη λειτουργία NF-kappaB και IKK. Nat Rev ΜοΙ Cell Biol. 2007; 8:49–62.
140. Gilmore TD. Εισαγωγή στο NF-kappaB: παίκτες, μονοπάτια, προοπτικές. Ογκογόνο. 2006; 25:6680-6684.
141. Hirota K, Murata M, Sachi Y, Nakamura H, Takeuchi J, Mori K, Yodoi J. Διακεκριμένοι ρόλοι της θειορεδοξίνης στο κυτταρόπλασμα και στον πυρήνα. Ένας μηχανισμός δύο σταδίων οξειδοαναγωγικής ρύθμισης του μεταγραφικού παράγοντα NF-kappaB. J Biol Chem. 1999; 274:27891-27897.
142. Θάλαμος ΠΑ. Ο ρόλος του συμπληρώματος, των χημειοκινών και των ρυθμιστικών κυτοκινών στην οξεία πνευμονική βλάβη. Ann NY Acad Sci. 1996;796:104-112.
143. Akira S, Kishimoto Α. NF-IL6 και NF-kB σε ρύθμιση γονιδίου κυτοκίνης. Adv Immunol. 1997; 65:1-46.
144. Meyer Μ, Schreck R, Baeuerle ΡΑ. Το H2O2 και τα αντιοξειδωτικά έχουν αντίθετα αποτελέσματα στην ενεργοποίηση των NF-kappa B και AP-1 σε άθικτα κύτταρα: AP-1 ως δευτερεύων παράγοντας που ανταποκρίνεται στα αντιοξειδωτικά. EMBO J. 1993; 12:2005–2015.
145. Abate C, Patel L, Rausher FJ, Curran Τ. Οξειδοαναγωγική ρύθμιση της δραστηριότητας δέσμευσης DNA fos και jun in vitro. Επιστήμη. 1990;249:1157-1161.
146. Galter D, Mihm S, Droge W. Διακεκριμένες επιδράσεις της δισουλφιδίου γλουταθειόνης στους παράγοντες πυρηνικής μεταγραφής kB και την πρωτεΐνη ενεργοποιητή-1. Eur J Biochem. 1994, 221:639-648.
147. Hirota K, Matsui M, Iwata S, Nishiyama A, Mori K, Yodoi J. Η μεταγραφική δραστηριότητα ΑΡ-1 ρυθμίζεται από μια άμεση συσχέτιση μεταξύ θειορεδοξίνης και Ref-1. Proc Natl Acad Sci US A. 1997;94: 3633–3638.
Δημοσίευση αποποίησης ευθυνών
Επαγγελματικό πεδίο πρακτικής *
Οι πληροφορίες εδώ στο "El Paso, TX Οξειδωτικό στρες και άμυνα αντιοξειδωτικώνΤο " δεν προορίζεται να αντικαταστήσει μια προσωπική σχέση με έναν εξειδικευμένο επαγγελματία υγειονομικής περίθαλψης ή εξουσιοδοτημένο ιατρό και δεν αποτελεί ιατρική συμβουλή. Σας ενθαρρύνουμε να λαμβάνετε αποφάσεις υγειονομικής περίθαλψης με βάση την έρευνα και τη συνεργασία σας με έναν εξειδικευμένο επαγγελματία υγείας.
Πληροφορίες ιστολογίου & Συζητήσεις πεδίου
Το εύρος των πληροφοριών μας περιορίζεται στη Χειροπρακτική, Μυοσκελετική, βελονισμός, φυσικά φάρμακα, ευεξία, συμβάλλοντας αιτιολογικά σπλαχνικές διαταραχές σε κλινικές παρουσιάσεις, σχετιζόμενη κλινική δυναμική του σωματοσπλαχνικού αντανακλαστικού, συμπλέγματα υπεξαρθρήματος, ευαίσθητα θέματα υγείας ή/και άρθρα, θέματα και συζητήσεις σχετικά με τη λειτουργική ιατρική.
Παρέχουμε και παρουσιάζουμε κλινική συνεργασία με ειδικούς από διάφορους κλάδους. Κάθε ειδικός διέπεται από το επαγγελματικό του πεδίο άσκησης και τη δικαιοδοσία αδειοδότησης. Χρησιμοποιούμε λειτουργικά πρωτόκολλα υγείας και ευεξίας για τη θεραπεία και υποστήριξη της φροντίδας για τραυματισμούς ή διαταραχές του μυοσκελετικού συστήματος.
Τα βίντεό μας, οι αναρτήσεις, τα θέματα, τα θέματα και οι πληροφορίες μας καλύπτουν κλινικά θέματα, ζητήματα και θέματα που σχετίζονται και υποστηρίζουν άμεσα ή έμμεσα το κλινικό πεδίο πρακτικής μας.*
Το γραφείο μας έχει εύλογα προσπαθήσει να παρέχει υποστηρικτικές αναφορές και έχει εντοπίσει τις σχετικές ερευνητικές μελέτες που υποστηρίζουν τις αναρτήσεις μας. Παρέχουμε αντίγραφα υποστηρικτικών ερευνητικών μελετών που διατίθενται σε ρυθμιστικά συμβούλια και στο κοινό κατόπιν αιτήματος.
Κατανοούμε ότι καλύπτουμε θέματα που απαιτούν μια πρόσθετη εξήγηση για το πώς μπορεί να βοηθήσει σε ένα συγκεκριμένο σχέδιο φροντίδας ή πρωτόκολλο θεραπείας. Επομένως, για να συζητήσετε περαιτέρω το θέμα παραπάνω, μη διστάσετε να ρωτήσετε Δρ Alex Jimenez, DC, ή επικοινωνήστε μαζί μας στο 915-850-0900.
Είμαστε εδώ για να σας βοηθήσουμε και την οικογένειά σας.
Ευλογίες
Δρ Alex Jimenez ΕΝΑ Δ, MSACP, Rn*, CCST, IfMCP*, Κηλίδα*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Άδεια γιατρού Χειροπρακτικής (DC) στο Τέξας & Νέο Μεξικό*
Άδεια Texas DC # TX5807, Νέο Μεξικό DC Άδεια # NM-DC2182
Άδεια εγγεγραμμένης νοσοκόμας (RN*) σε Φλόριντα
Άδεια Φλόριντα RN Άδεια # RN9617241 (Αρ. ελέγχου. 3558029)
Κατάσταση συμπαγούς: Πολυκρατική Άδεια: Εξουσιοδοτημένος για εξάσκηση σε Τα κράτη 40*
Προς το παρόν εγγραφές: ICHS: MSN* FNP (Πρόγραμμα Family Nurse Practitioner)
Dr. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Η ψηφιακή μου επαγγελματική κάρτα


 Και πάλι σας καλωσορίζουμε¸
Και πάλι σας καλωσορίζουμε¸
